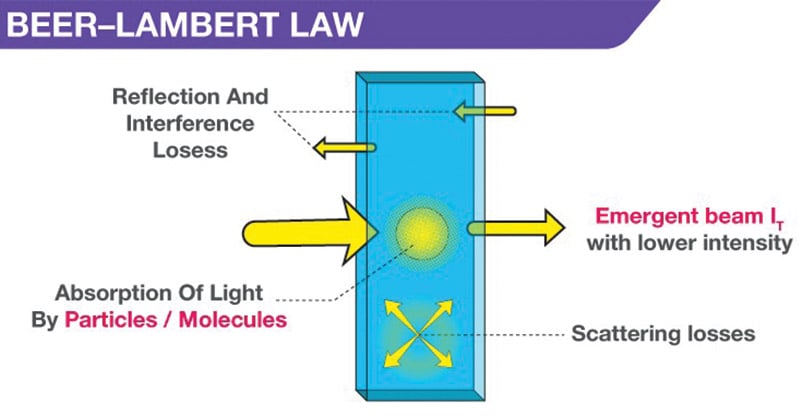
La ley de Beer-Lambert ley de Beer, también conocida como ley de Beer, ley de Lambert-Beer o ley de Beer-Lambert-Bouguer, relaciona la atenuación de la luz con las propiedades del material por el que viaja la luz.
¿Qué es la Ley de Beer-Lambert?
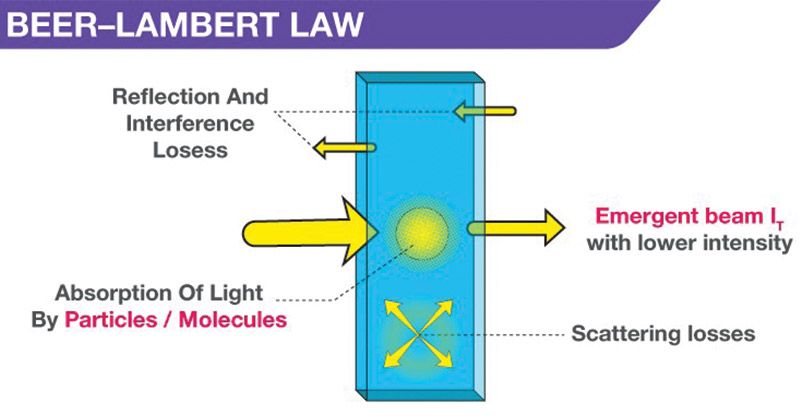
- Cuando una luz monocromática de intensidad inicial Io pasa a través de una solución en un recipiente transparente, parte de la luz es absorbida, de modo que la intensidad de la luz transmitida I es menor que Io.
- Hay una cierta pérdida de intensidad de la luz por la dispersión de las partículas de la solución y la reflexión en las interfases, pero principalmente por la absorción de la solución.
- La relación entre I e Io depende de la longitud del camino del medio absorbente, l, y de la concentración de la solución absorbente, c. Estos factores están relacionados en las leyes de Lambert y Beer.
Derivación de la Ley de Beer-Lambert
- Si los cuerpos materiales se exponen a la radiación, una parte de la radiación incidente se absorbe, otra se dispersa y otra se transmite.
- Como consecuencia de la absorción, disminuye la intensidad de la luz que atraviesa los cuerpos materiales, es decir, la intensidad de la luz transmitida.
- La fracción de luz incidente absorbida depende del grosor del medio absorbente.
- Lambert dedujo una relación cuantitativa entre la disminución de la intensidad de una luz monocromática debida al paso por un medio homogéneo de espesor dx y la intensidad de la luz I. Esta ley se conoce como ley de Lamberts, y puede enunciarse como
- La disminución de la intensidad de la luz con el espesor del medio absorbente en cualquier punto es directamente proporcional a la intensidad de la luz.
Matemáticamente se puede expresar como
- 𝑑𝐼 / 𝑑𝑥 ∝ 𝐼 - - - - - (1)
Lectura relacionada: Espectroscopia de RMN - Definición, Principio, Pasos, Partes, Usos
Espectroscopia de RMN - Definición, Principio, Pasos, Partes, UsosDonde dI es una pequeña disminución de la intensidad de la luz al atravesar una pequeña distancia dx y I es la intensidad de la luz monocromática justo antes de entrar en el medio.
La ecuación (1) puede escribirse como
- 𝑑𝐼 / 𝑑𝑥 = 𝑎𝐼 - - - - - (2)
Lectura relacionada: 14 Tipos de Cromatografía (Definición, Principio, Pasos, Usos)
14 Tipos de Cromatografía (Definición, Principio, Pasos, Usos)Donde - 𝑑𝐼/ 𝑑𝑥 es la tasa de disminución de la intensidad con el grosor dx , a se llama coeficiente de absorción.
La integración de la ecuación (2) después de la reordenación da,
- ln I = ax+C - - - - - (3)
Lectura relacionada: Cromatografía de intercambio iónico - Definición, principio, partes, pasos, usos
Cromatografía de intercambio iónico - Definición, principio, partes, pasos, usosDonde C es una constante de integración. En x=0, I=Io. Por tanto, C = - ln Io. Introduciendo esto en la ecuación (3) obtenemos
ln I/ Io = - ax - - - - - (4)
La ecuación (4) también puede escribirse como
I = Io 𝑒-𝑎𝑥 - - - - - - (5)
La ecuación (5) también puede escribirse como
log I/ Io = - a/ 2,303 x - - - - (6)
o bien, log I/ Io = -a` x - - - - (7)
Donde a` (= a /2,303 ) se llama coeficiente de extinción y -ln I/ Io se denomina absorbancia del medio. La absorbancia está representada por A.
La ley de Lambert fue ampliada por Beer, que demostró que
cuando la luz atraviesa una solución de un grosor determinado, la fracción de luz incidente absorbida depende no sólo de la intensidad I de la luz, sino también de la concentración c de la solución.
Esto se conoce como la ley de Beer.
- 𝑑𝐼 /𝑑𝑥 ∝ 𝑐 - - - - - (8)
Las dos leyes pueden combinarse para escribir
- 𝑑𝐼 /𝑑𝑥 ∝ 𝐼 × 𝑐
O bien, - 𝑑𝐼 /𝑑𝑥 = 𝑏 × 𝐼 × 𝑐 - - - - (9)
Cuando la concentración, c, se expresa en mol /L, b se denomina coeficiente de absorción molar.
Como en el caso de la ley de Lambert, la ecuación (9) puede transformarse en
log I/ Io = - 𝑏 /2,303 × 𝑐 × 𝑥 - - - - (10)
log I/ Io = - ∈× 𝑐 × 𝑥 - - - - - (11)
Donde ∈ (= 𝑏 / 2,303) se denomina coeficiente de extinción molar que se expresa en L/mol/cm.
El coeficiente de extinción molar ∈ depende de la naturaleza del soluto absorbente, así como de la longitud de onda de la luz incidente utilizada. La expresión (ecuación 11) se conoce comúnmente como ley de Beer-Lambert.
Limitaciones de la ley de Beer-Lambert
La linealidad de la ley de Beer-Lambert está limitada por factores químicos e instrumentales.
Las causas de la no linealidad de la ley se dan en las siguientes condiciones
- desviaciones en los coeficientes de absorción a altas concentraciones (>0,01M) debido a las interacciones electrostáticas entre las moléculas cercanas
- la dispersión de la luz debida a las partículas de la muestra
- fluorescencia o fosforescencia de la muestra
- cambios en el índice de refracción con una alta concentración de analito
- desplazamientos de los equilibrios químicos en función de la concentración
- radiación no monocromática, las desviaciones pueden minimizarse utilizando una parte relativamente plana del espectro de absorción, como el máximo de una banda de absorción
- luz parásita
Otras limitaciones son:
- La radiación electromagnética debe ser monocromática.
- El haz de luz no debe dispersarse.
- La solución debe estar diluida.
Referencias
- http://life.nthu.edu.tw/~labcjw/BioPhyChem/Spectroscopy/beerslaw.htm
- https://www.slideshare.net/MorshedulHaque/beer-lamberts-law
- https://www.slideshare.net/JALEEL/beer-lambert
- https://en.wikipedia.org/wiki/Beer%E2%80%93Lambert_law
- https://pubs.acs.org/doi/pdf/10.1021/ed074p744.3
- http://www.collin.edu/chemistry/Handouts%202009/Beer's%20Ley.pdf