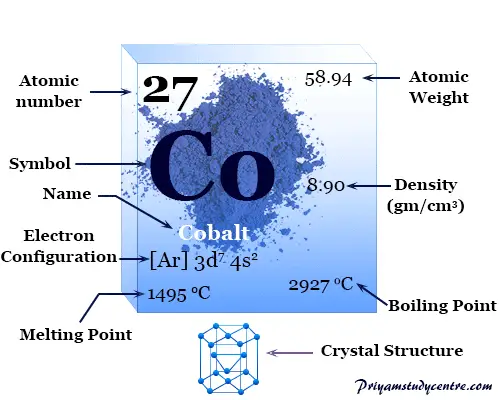
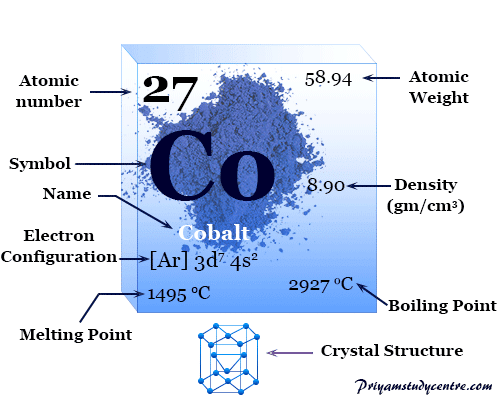
Metal Cobalto
Cobalto es un elemento químico, metal de transición ferromagnético gris plateado brillante del grupo 9 (VIIIB) de la tabla periódica con número atómico 27 y símbolo Co. El cobalto metálico finamente dividido es pirofórico como el hierro, pero el metal compacto no es atacado por moléculas de aire o agua a temperatura normal.
Se utiliza en la fabricación de varios tipos de aleaciones y grandes cantidades de sus compuestos se utilizan en las industrias del vidrio y la cerámica. La dureza y la resistencia a la tracción del cobalto son más altas que las del acero.
Lectura relacionada: Acero, Especies, Composición, Uso, Propiedades, Producción
Acero, Especies, Composición, Uso, Propiedades, ProducciónEl metal se disuelve peor en ácidos minerales como el ácido nítrico y el ácido sulfúrico. No ataca a los álcalis acuosos como NaOH o KOH, pero se disuelve fácilmente en KOH fundido a 550 °C.
Historia y descubrimiento
La historia del descubrimiento del cobalto puede comenzar con su nombre. El nombre del metal de la palabra alemana cobold significa espíritu maligno o kobold.
En 1735, el químico sueco G. Brandt analizó algunos especímenes de cobold y escribió sobre un nuevo semimetal al que llamó cobold. Brandit describe seis semimetales como mercurio, bismuto, zinc, antimonio, cobalto y arsénico.
Lectura relacionada: Escandio, Símbolo, Propiedades, Hechos, Uso
Escandio, Símbolo, Propiedades, Hechos, UsoAntes de 1776, muchos científicos creían que el elemento era un compuesto de hierro y arsénico. La identidad del cobalto como metal nuevo fue establecida alrededor de 1780 por T Bergmann y otros científicos.
¿Dónde se encuentra el cobalto?
El cobalto es menos común entre los primeros metales de transición, excepto el escandio. Es el trigésimo elemento más abundante de todos los elementos conocidos que se encuentran principalmente con níquel y arsénico.
Los principales minerales de cobalto son los arseniuros y sulfuros como la esmaltita, CoAs2eritrita, Co3(AsO4)2. Además del arsénico, el azufre y el hierro contienen de 4 a 10 por ciento de cobalto y cantidades variables de plata, cobre y plomo.
Lectura relacionada: Aluminio, propiedades, descubrimiento, uso, conexiones.
Aluminio, propiedades, descubrimiento, uso, conexiones.Sudáfrica y Canadá son los principales productores de cobalto. Se encuentra una pequeña reserva de metal en Australia y los países rusos.
Propiedades del cobalto
La red cristalina hexagonal de cobalto tiene una configuración electrónica con escala de valencia [Ar] 3d7 4s2. El número o estado de oxidación +2 y +3 es importante para derivar diferentes tipos de enlaces químicos y compuestos de metal.
El Co(II) es más estable que el Co(III) en soluciones ácidas. El cobalto metálico finamente dividido es pirofórico como el hierro, pero el metal compacto no es atacado por el aire o el agua a temperaturas normales.
Algunas propiedades físicas y atómicas importantes del cobalto se dan debajo de la tabla,
| Cobalto | |||
| Símbolo | Co | ||
| Descubrimiento | George Brandt en 1739 | ||
| Nombre derivado de | La palabra alemana kobald significa kobold | ||
| isótopo común | 27Co59 | ||
| Estados de oxidación | +3, +20, −1 | ||
| número CAS | 7440-48-4 | ||
| Propiedades periódicas | |||
| número atómico | 27 | ||
| Masa atómica relativa | 58,933 | ||
| electrón por celda | 2, 8, 15, 2 | ||
| Configuración electrónica | [Ar] 3d7 4s2 | ||
| Bloquear | bloque d | ||
| Grupo | 9 | ||
| Período de tiempo | 4 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1495 °C, 2723 °F, 1768 K | ||
| Punto de ebullición | 2927°C, 5301°F, 3200K | ||
| Capacidad calorífica molar | 24,81 J mol−1 k1 | ||
| estructura cristalina | empaquetado herméticamente hexagonal (hcp) | ||
| Espesor | 8,86 g/cm3 | ||
| Resistencia eléctrica | 64,2nm | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2,00 € | ||
| Radio covalente | 1.18 | ||
| electronegatividad | 1,88 (escala de Pauling) | ||
| Afinidad electronica | 63. 87 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 760.40 | 1648.36 | 3232.30 | |
Cobalto en tabla periódica
El cobalto se coloca en el período 4 y el grupo 9 en la tabla periódica con los miembros del grupo rodio e iridio. Es un miembro de los elementos del bloque d o metales de transición.
Datos sobre el cobalto
- El cobalto es un metal plateado brillante con un tinte azulado.
- La dureza y la resistencia a la tracción del metal son mayores que las del acero.
- Es un metal ferromagnético con un alto punto de Curie (1121 °C).
- El metal cobalto, cuando se calienta, reacciona con la mayoría de los halógenos como el flúor, el cloro, el bromo y otros no metales como el boro, el carbono, el fósforo y el azufre.
Ingredientes químicos
El diagrama de energía libre del estado de oxidación muestra que los compuestos químicos más comunes e importantes del cobalto se forman en los estados de oxidación +2 y +3. En una solución ácida, el Co(II) es más estable que el Co(III).
A continuación se describen algunos compuestos químicos importantes del metal.
óxido de cobalto
El óxido de cobalto (II) (fórmula química CoO) se forma cuando se pasa vapor sobre metal al rojo vivo o carbonato de Co (II), nitrato, etc. El óxido es un sólido de color verde oliva que es estable hasta 1000°C. Cuando el CoO se calentó en el aire, formó Co3O4.
Óxido de Co(II) disuelto en álcali concentrado para formar una solución de color azul intenso [Co(OH)4]−2. Tiene una estructura de sal de roca. Normalmente, la estructura contiene un exceso de oxígeno que se comporta como un semiconductor de tipo p.
El óxido de Co(III) marrón hidratado se forma cuando el Co(OH)2 se oxida en un medio alcalino. Se puede secar a 150 °C hasta la composición Co2O3¿eh?2O. Calentamiento adicional, formas Co2O3.
La oxidación de Co(II) acuoso en un ambiente alcalino por cloro, oxígeno y ozono forma un óxido negro hidratado CoO2pero esto no ha sido bien caracterizado.
Óxido mixto
Varias especies de óxidos mixtos de cobalto se forman en el estado de oxidación +4. Por ejemplo, M.2Arrullo3 (M = K, Rb, Cs), Li8Arrullo8 y ba2Arrullo4. Estos últimos compuestos tienen la misma estructura que el K2ASI QUE4.
Se prepara calentando Co(OH)2 con Ba(OH)2 o BaCO3 en oxígeno a 1050°C. Asimismo, la fusión de CoO4 con NaO2 produce Na4Arrullo4. Contiene el CoO tetraédrico4 anión con Na+ catión coordinado con átomos de oxígeno.
Un compuesto como Cs2CdF6 se prepara por fluoración de Cs2CoCl4. es isomorfo a Cs2SiF6.
Compuestos de haluros de cobalto
El haluro como CoF2 está hecho por la sal doble (CoF22NH4F) o por la acción de HF sobre CoCl2. Los demás haluros de Co(II) se obtienen por reacción directa de cobalto metálico y halógenos como cloro, bromo y yodo.
Fluoruro de cobalto (III)
El fluoruro de cobalto (III) es un polvo de color marrón claro con la fórmula química CoF3. Se obtiene por CoF. calentar2 o CoCl2 en flúor.
CdF3 reacciona violentamente con el agua generando oxígeno. Es un agente fluorante fuerte que fluora los hidrocarburos para formar hidrofluorocarbonos.
Conexiones complejas
En el estado +3, Co ad. tiene6 configuración que obtiene la ventaja de la energía de estabilización de campo de cristal grande (CFSE) con ligandos de campo fuerte.
Werner muestra que el Co(II) forma una serie de complejos de amina y la hexamina naranja, [Co(NH3)6]+3 se forma fácilmente por oxidación con aire de Co(II) acuoso en presencia de amoníaco y sales de amonio.
El bajo estado de oxidación del cobalto (1.0 y -1) se encuentra con ligandos fuertes de unión a pi como carbonilo (CO), nitrosilo (NO) y cianógeno (CN) ión.
¿Cómo detectar metales?
El metal cobalto se puede detectar fácilmente por el color azul profundo que se produce en los granos de bórax, que permanece sin cambios cuando se reduce la llama.
La solución que contiene Co(II) produce un precipitado amarillo con una solución de nitrato de potasio en medio con exceso de ácido acético.
uso de cobalto
Antes del siglo XIX, se usaban grandes cantidades de compuestos de cobalto en las industrias del vidrio y la cerámica. Hoy en día se utiliza en diversos campos, como las aleaciones o la fabricación de baterías y catalizadores químicos.
- Los pigmentos azules de los compuestos de cobalto se utilizan en las industrias del vidrio y la cerámica por su color artístico.
- Casi el 30 por ciento de la producción total de metales (alrededor de 10.000 toneladas por año en el mundo) se utiliza para fabricar pinturas o tintes.
- Casi la misma cantidad de Co se utiliza para fabricar aleaciones de alta calidad. Estas aleaciones se utilizan para fabricar piezas de aviones, palas de turbinas de gas y acero de alta velocidad.
- Muchos compuestos de cobalto también se utilizan como catalizadores químicos en una serie de reacciones orgánicas, petróleo e industrias químicas.
- Las sales de cobalto se utilizan para acelerar la oxidación de las pinturas a base de aceite. Por lo tanto, se utiliza como agente secante en pinturas.
- El cobalto-60 radiactivo es un emisor beta que se usa para tratar el cáncer.