
¿Qué es el lutecio?
Lutecio es un elemento químico o metal de tierras raras en la tabla periódica con el símbolo Lu y número atómico 71. Debido a eventos raros, problemas de fabricación y precios altos, el lutecio se usa solo con fines de investigación.

Comercialmente, se utiliza como catalizador químico para el craqueo de hidrocarburos en refinerías de petróleo. Actualmente, el lutecio-177 es un radiometal útil en la terapia con radionúclidos para el tratamiento de tumores neuroendocrinos y cáncer de próstata.
Lectura relacionada: Tulio - Elemento, Símbolo, Uso, Hechos
Tulio - Elemento, Símbolo, Uso, HechosEl lutecio fue descubierto de forma independiente por el científico francés Georges Urbain, el mineralogista austriaco Baron Carl Auer von Welsbach y el químico estadounidense Charles James en 1907. El nombre del metal de tierras raras se deriva de la palabra Lutetia, el antiguo nombre de París.
¿Dónde se encuentra el lutecio?
El metal lutecio libre nunca se encuentra en la corteza terrestre, pero se encuentra en casi todos los demás minerales de tierras raras. El mineral de lutecio más común y comercialmente importante es la monacita. Debido a los problemas de aislamiento y la abundancia muy rara, el metal es muy caro de comprar.
No se encuentran minerales dominantes de lutecio en la corteza terrestre. La principal región minera del metal es China, Estados Unidos, Brasil, India, Sri Lanka y Australia.
Lectura relacionada: Holmio - Elemento, Símbolo, Uso, Hechos
Holmio - Elemento, Símbolo, Uso, Hechosisótopos
El lutecio natural es una mezcla de dos isótopos estables con una masa atómica de 175 a 176. Se han obtenido al menos 34 isótopos radiactivos mediante diversas reacciones nucleares artificiales. El elemento también contiene 43 isómeros nucleares.
La mayoría de estos isótopos radiactivos tienen una vida media de menos de media hora. El principal modo de desintegración radiactiva de los isótopos de lutecio es la captura de electrones o desintegración beta.
Lutecio-177
Actualmente, el lutecio-177 es el radiometal más utilizado en la terapia con radionúclidos para el tratamiento de tumores neuroendocrinos y cáncer de próstata. Lu-177 es un emisor de energía media y deposita energía de corto alcance en los tejidos. Reduce los efectos tóxicos sobre los tejidos normales y es adecuado para el tratamiento del cáncer metastásico.
Lectura relacionada: Disprosio - Elemento, Símbolo, Uso, Hechos
Disprosio - Elemento, Símbolo, Uso, HechosPuede producirse en reactores nucleares por reacciones nucleares directas o indirectas.
- En el proceso de producción directa, 176lu da 177Lu con alguna impureza de larga vida 177mLu. Tiene una actividad específica limitada debido a la presencia de impurezas.
- En el proceso de producción indirecta, 176Yb irradia para dar 177Lu sin impureza de 177mLu. Por lo tanto, tiene una alta actividad específica.
Propiedades
El lutecio es un metal blanco plateado que resiste la corrosión en aire seco, pero no en ambientes húmedos. Es el átomo más pequeño entre los átomos de lantánidos debido a la contracción de los lantánidos. Por lo tanto, la densidad, el punto de fusión y la dureza del metal son los más altos entre los lantánidos.
| lutecio | |||
| Símbolo | Lu | ||
| Descubrimiento | Georges Urbain e independiente por Charles James en 1907 | ||
| Nombre derivado de | El nombre romano de París significa Lutetia. | ||
| isótopo común | 71Lu175 | ||
| Estados de oxidación | +3 | ||
| número CAS | 7439-94-3 | ||
| Propiedades periódicas | |||
| número atómico | 71 | ||
| Masa atómica relativa | 174,967 | ||
| electrón por celda | 2, 8, 18, 32, 9, 2 | ||
| Configuración electrónica | [Xe] 4f14 5d1 6s2 | ||
| Bloquear | bloque f | ||
| Grupo | lantánidos | ||
| Período de tiempo | 6 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1663°C, 1936 K | ||
| Punto de ebullición | 3402 °C, 3675 K | ||
| Capacidad calorífica molar | 27,20 J mol−1 k1 | ||
| estructura cristalina | empaquetado herméticamente hexagonal (hcp) | ||
| Espesor | 9,84 g/cm23 | ||
| Calor de fusión | 22 kJ mol−1 | ||
| Calor de evaporación | 414 kJ mol−1 | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.24 | ||
| Radio covalente | 1.74 | ||
| electronegatividad | 1,00 (escala de Pauling) | ||
| Afinidad electronica | 32,81 kJ mol−1 | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 523.52 | 1341.10 | 2022.27 | |
Lutecio en la tabla periódica
El lutecio, un metal de tierras raras, se coloca en el bloque f de la tabla periódica. Es el último miembro de la serie de los lantánidos que se encuentra después del iterbio.
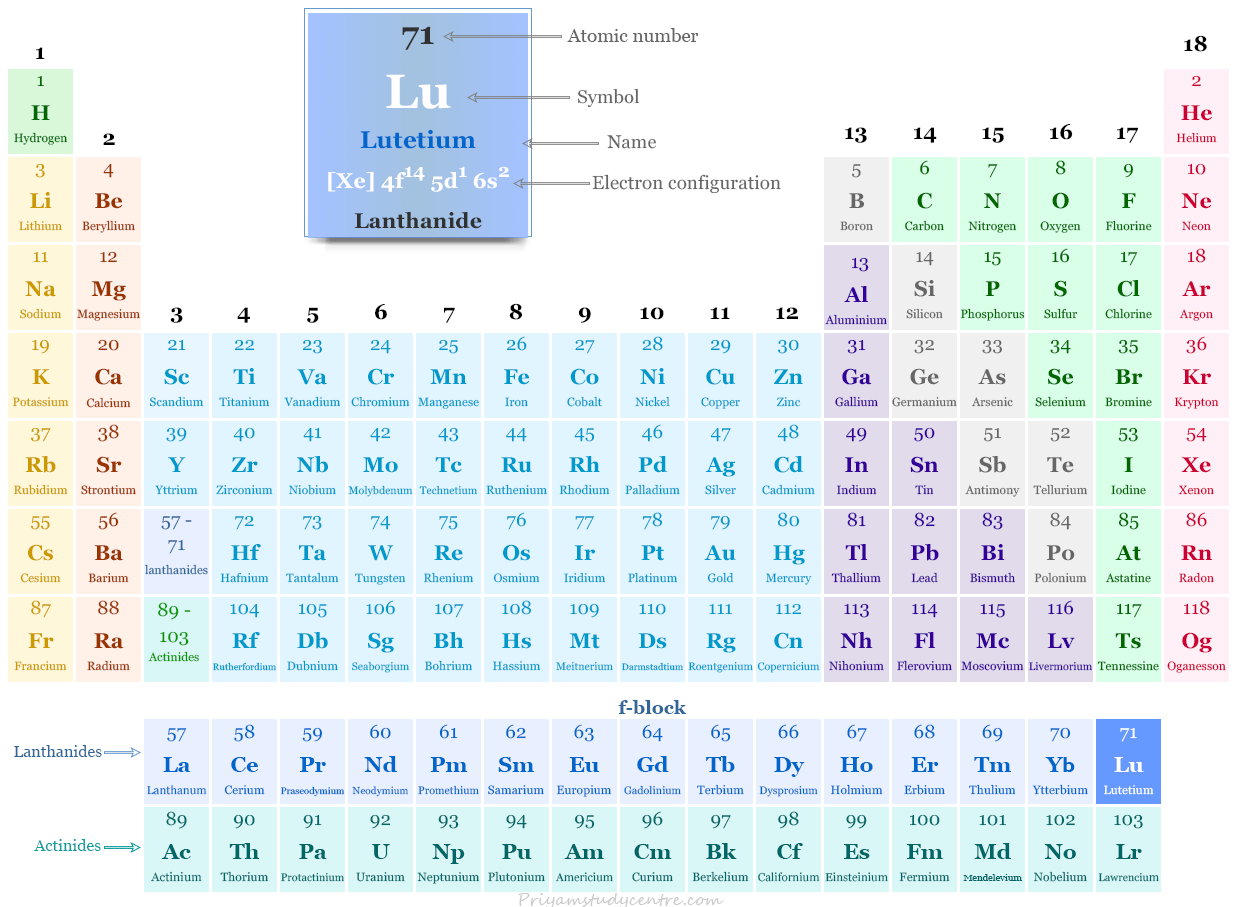
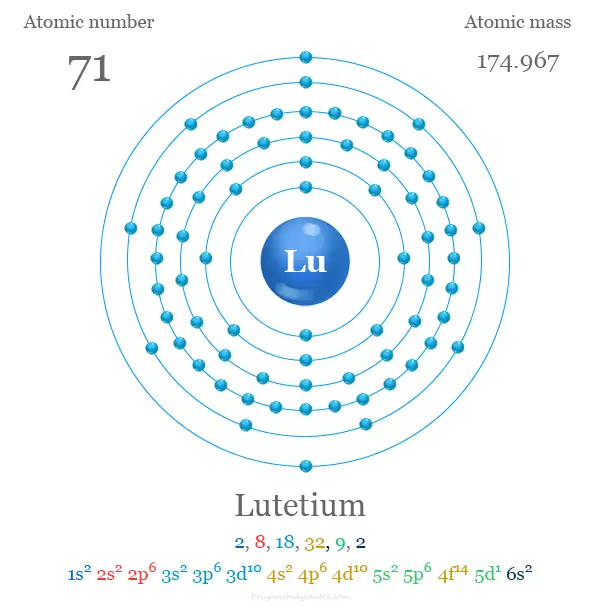
Configuración electrónica del lutecio
Los 71 electrones del átomo de lutecio se dividen en diferentes niveles de energía para mostrar la siguiente configuración electrónica que se muestra debajo de la imagen,
Propiedades químicas
Como la mayoría de los otros lantánidos, generalmente muestra un número o estado de oxidación de +3, pero también se encuentran compuestos con estados 0, +1 y +2. Con la excepción del yoduro, las soluciones acuosas de la mayoría de las sales de lutecio son incoloras y cristalizan para formar sólidos cristalinos blancos.
Es algo inestable en aire seco en condiciones normales, pero se embota rápidamente en atmósferas húmedas. Reacciona fácilmente con oxígeno a 150 °C para formar óxido Lu(III) Lu. Dar forma2O3. El óxido resultante es un absorbente de agua y dióxido de carbono.
4 Lu + 3 O2 → 2 Lu2O3
Reacciona lentamente con agua fría y rápidamente con agua caliente para liberar hidrógeno y formar hidróxido de Lu(III).
2 Lu + 6 H2O → 2 Lu(OH)3 + 3 horas2
Forma sales de trihaluro cuando reacciona con halógenos como flúor, cloro, bromo y yodo. Excepto el fluoruro, todas las sales de haluros son solubles en agua.
2 Lu + 3 X2 → 2 lux3 (X = F, Cl, Br, I)
Se disuelve fácilmente con ácidos minerales fuertes como el ácido sulfúrico, el ácido nítrico o el ácido clorhídrico. En ácido sulfúrico diluido forma una solución incolora que contiene el Lu incoloro. contiene+3 iones
2 Lu + 3 H2ASI QUE4 + 18 horas2O → 2 [Lu(H2O)9]3+ + 3 SO4−2 + 3 horas2
Datos sobre el lutecio
- Fue el último elemento natural de tierras raras descubierto por tres científicos independientes. El crédito por el descubrimiento se le dio a Georges Urbain por ser el primero en publicar sus resultados.
- Es el elemento más duro que contiene el tamaño atómico más pequeño de todos los lantánidos.
- El lutecio-177 es el isótopo metálico más utilizado para los tumores neuroendocrinos y el cáncer de próstata.
- El precio del lutecio es muy alto debido a su dificultad de extracción y su rara aparición.
- No juega ningún papel biológico en humanos con muy baja toxicidad.
Uso de lutecio
El lutecio rara vez se usa fuera de la investigación debido a su rara ocurrencia, dificultades de fabricación y alto precio. Tiene muy pocos usos comerciales.
- El lutecio se puede utilizar como catalizador químico para el craqueo de hidrocarburos en las refinerías de petróleo.
- También se puede utilizar para procesos de alquilación, hidrogenación y polimerización.
- Está dopado con granate de gadolinio galio y se utiliza en dispositivos de memoria de burbujas magnéticas.
- El isótopo, Lu-176, se ha utilizado como emisor beta puro debido a su vida media y modo de decaimiento radiactivo.
- Actualmente, el oxiortosilicato de lutecio dopado con cerio se utiliza como detector en la tomografía por emisión de positrones.
- Los isótopos radiactivos de lutecio se utilizan en la terapia dirigida con radionúclidos para tumores neuroendocrinos.
- Actualmente, el lutecio-177 es el radiometal más utilizado en la terapia con radionúclidos para el tratamiento de tumores neuroendocrinos y cáncer de próstata.
- Varios tipos de investigación sugieren que los relojes atómicos de iones de Lu ofrecen una mayor precisión que cualquier reloj atómico existente fabricado con cesio o rubidio.
Precio del lutecio
El metal puro es muy difícil de preparar. Por lo tanto, el lutecio puro es una de las tierras raras más raras y caras con un precio promedio de $10,000 por kilogramo. El precio medio del lutecio puro es la cuarta parte del precio del oro.












