
¿Qué es el Disprosio?
Disprosio es un elemento químico o metal de tierras raras en la tabla periódica con el símbolo Dy y número atómico 66. El disprosio puro es un metal de tierras raras blanco plateado y relativamente duro. Es bastante estable en el aire y se oxida en presencia de oxígeno.

La aplicación de una forma pura de disprosio es muy pequeña. El metal y sus compuestos se utilizan principalmente para mejorar la procesabilidad de los imanes de boro de hierro de neodimio, materiales absorbentes de neutrones para barras de control en reactores nucleares, materiales láser e iluminación comercial.
Lectura relacionada: Francio, Símbolo, Propiedades, Hechos, Uso
Francio, Símbolo, Propiedades, Hechos, UsoEl disprosio fue identificado por primera vez en 1886 por el químico francés Paul Émile Lecoq de Boisbaudran. La forma pura del elemento no se aisló antes del descubrimiento de las técnicas de cromatografía de intercambio iónico. El nombre del metal de tierras raras se le dio a la palabra griega dysprositos que significa difícil de conseguir.
¿Dónde se encuentra el disprosio?
Nunca se encuentra en la naturaleza como un elemento libre y aún no se ha encontrado ningún mineral dominante de disprosio en la corteza terrestre. Al igual que otros varios lantánidos, el disprosio se encuentra en los minerales monacita y bastnaesita. También se puede encontrar en cantidades más pequeñas en xenotima y fergusonita.
Puede extraerse o separarse de minerales de tierras raras mediante cromatografía de intercambio iónico y extracción con disolventes. Hoy en día se sintetiza principalmente a través de un proceso de intercambio iónico a partir de arena de monacita.
Lectura relacionada: Rubidio - Metal, Símbolo, Propiedades, Uso
Rubidio - Metal, Símbolo, Propiedades, Usoisótopos
El disprosio natural tiene siete isótopos con masas atómicas que van desde 156 a 164. También contiene 29 isótopos radiactivos que pueden sintetizarse mediante diversas reacciones nucleares artificiales. Las masas atómicas de estos isótopos radiactivos oscilan entre 138 y 173. También contiene 11 isómeros metaestables.
El isótopo radiactivo más estable es 154Dy (vida media 3×106 años), mientras que el isótopo radiactivo menos estable es 138Dy (vida media 200 ms). El principal modo de desintegración radiactiva de los isótopos de disprosio es la captura de electrones o la desintegración alfa o la desintegración beta.
En química médica, el isótopo es 165Dy se utiliza en la terapia de artritis o radiosinovectomía.
Lectura relacionada: Mercurio - Hechos, Elemento, Uso, Propiedades
Mercurio - Hechos, Elemento, Uso, PropiedadesPropiedades
El disprosio es un sólido blando de color blanco plateado a temperatura ambiente. Se oxida en el aire para formar una capa de óxido. El metal es lo suficientemente blando para cortarlo con un cuchillo y es fácilmente atacado y disuelto por ácidos minerales diluidos y concentrados como el ácido sulfúrico, nítrico o clorhídrico.
| disprosio | |||
| Símbolo | dy | ||
| Descubrimiento | Paul-Émile Lecoq de Boisbaudran en 1886 | ||
| Nombre derivado de | La palabra griega dysprositos significa difícil de conseguir | ||
| isótopo común | 66dy164 | ||
| Estados de oxidación | +3 | ||
| número CAS | 7429-91-6 | ||
| Propiedades periódicas | |||
| número atómico | 66 | ||
| Masa atómica relativa | 162,500 | ||
| electrón por celda | 2, 8, 18, 28, 8, 2 | ||
| Configuración electrónica | [Xe] 4f10 6s2 | ||
| Bloquear | bloque f | ||
| Grupo | lantánidos | ||
| Período de tiempo | 6 | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 1412 °C, 1685 K | ||
| Punto de ebullición | 2567°C, 2840K | ||
| Capacidad calorífica molar | 27,7 J mol−1 k1 | ||
| estructura cristalina | empaquetado cerrado hexagonal (hcp) | ||
| Espesor | 8,55 g/cm23 | ||
| Calor de fusión | 11,06 kJ mol−1 | ||
| Calor de evaporación | 280 kJ mol−1 | ||
| Propiedades atómicas | |||
| Radio atómico (sin consolidar) | 2.31 | ||
| Radio covalente | 1.80 | ||
| electronegatividad | 1,22 (escala de Pauling) | ||
| Afinidad electronica | Desconocido | ||
| Energía de ionización (kJ/mol) | 1º | 2do | 3ro |
| 573.02 | 1125.98 | 2199.90 | |
Configuración electrónica del disprosio
Los 66 electrones de disprosio se dividen en diferentes orbitales para dar la siguiente configuración electrónica,
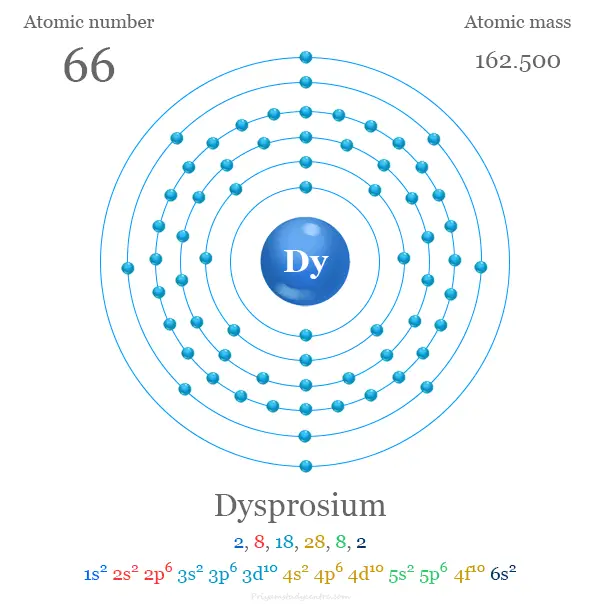
La configuración electrónica de la capa de valencia del metal es [Xe] 4f10 6s2. Al igual que otros lantánidos, generalmente usa tres electrones con fines de enlace químico para mostrar un número o estado de oxidación de +3.
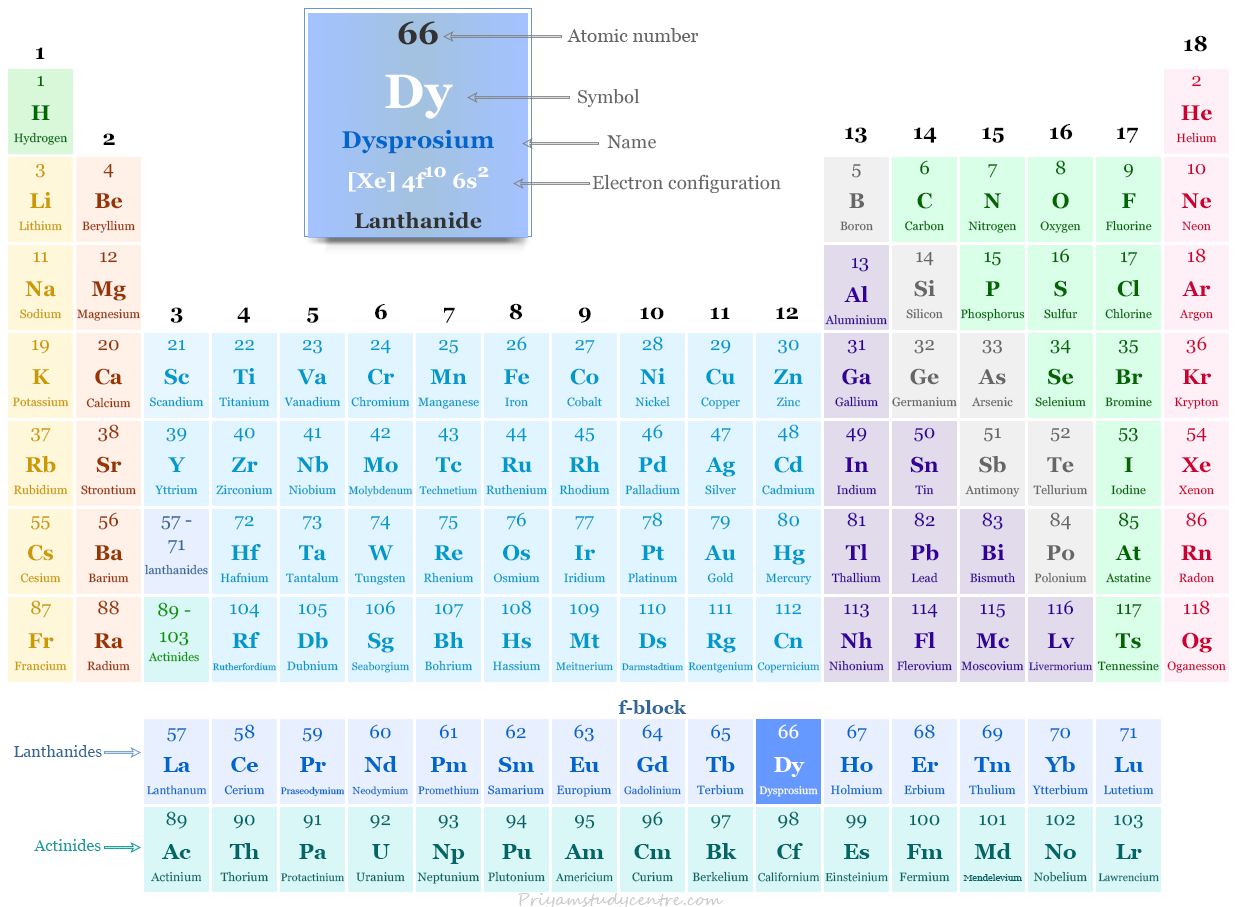
Disprosio en la tabla periódica
El disprosio, un metal de tierras raras, se coloca entre los elementos del bloque f de la tabla periódica. Es el lantánido que se encuentra entre el terbio y el holmio.
Propiedades químicas
Es relativamente estable en el aire a temperatura ambiente, pero forma una capa de óxido de Dy(III) en una atmósfera húmeda.
4 Dy + 3 O2 → 2 Dy2O3
El metal puro es un elemento bastante electropositivo y peligroso para el medio ambiente porque reacciona con el agua para formar gas hidrógeno inflamable.
2 Días + 6 H2O → 2 Dy(OH)3 + 3 horas2
Se descompone para formar DyO(OH) a temperaturas elevadas, pero se descompone nuevamente para formar óxido de Dy(III).
Se disuelve fácilmente en ácido sulfúrico diluido para formar soluciones que contienen iones amarillos Dy(III). La reacción química formó sulfato de disprosio (III) paramagnético.
2 Dy + 3 H2SO4 → 2 Dy3+ + 3 SO4−2 + 3 H2
Datos sobre el disprosio
- Paul Lecoq de Boisbaudran identificó el disprosio en 1886, pero el metal puro no se puede aislar antes de la década de 1950.
- La abundancia de disprosio de tierras raras es de 5,2 mg/kg en la corteza terrestre y de 0,9 ng/L en el agua de mar.
- Pequeñas cantidades de impurezas pueden influir fuertemente en las propiedades físicas del metal de tierras raras Dy.
- Es ampliamente utilizado en la producción de imanes a base de neodimio debido a sus propiedades ferromagnéticas a temperaturas inferiores a 85K.
- El polvo de disprosio y la lámina delgada pueden explotar en presencia de una chispa y el fuego no se puede extinguir con agua.
- Las sales solubles del metal son ligeramente tóxicas, mientras que las sales insolubles no son tóxicas por naturaleza.
- El nitrato de disprosio se encenderá al entrar en contacto con la piel humana y otros compuestos orgánicos.
- No puede desempeñar ningún papel biológico en humanos u otros animales.
- El precio de la forma pura de disprosio es de aproximadamente $450 a $500 por 100 gramos.
Uso de disprosio
- El disprosio se utiliza principalmente en aleaciones de imanes a base de neodimio. Por lo general, el 6% del neodimio se reemplaza por disprosio en los imanes de boro de hierro de neodimio. Estos imanes se utilizan ampliamente para fabricar turbinas eólicas y vehículos eléctricos. Es resistente a las propiedades de desmagnetización a altas temperaturas.
- Se utiliza en el sistema de almacenamiento de datos porque Dy tiene una alta sensibilidad magnética.
- El disprosio también es útil para mejorar las propiedades de resistencia a la corrosión de los imanes.
- Terfenol-D contiene hierro y terbio con disprosio.
- Se utiliza en las barras de control de los reactores nucleares debido a su capacidad de absorción de neutrones.
- La combinación de metales de tierras raras con vanadio y otros elementos se utiliza para fabricar materiales láser e iluminación comercial.
- El granate de itrio y aluminio dopado se excita en la región ultravioleta del espectro electromagnético. Da como resultado la emisión de fotones de mayor longitud de onda en la región visible.
- El yoduro y el bromuro de disprosio se utilizan para fabricar lámparas de halogenuros metálicos de alta intensidad.












