Que diferencia principal entre composición y estequiometría de reacción La estequiometría composicional se refiere a la composición atómica de un compuesto químico, mientras que la estequiometría de reacción se refiere a la cantidad de compuestos consumidos o producidos durante una reacción química.
La estequiometría es un término químico que describe los datos cuantitativos sobre un compuesto químico o una reacción química. Cuando estos datos se refieren a un compuesto químico, lo llamamos estequiometría composicional; Si es una reacción química, podemos llamarla estequiometría de reacción.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la estequiometría composicional?
3. ¿Qué es la estequiometría de reacción?
4. Comparación lado a lado: composición frente a estequiometría de reacción en forma tabular
5. Resumen
 Diferencia entre DCC y EDC
Diferencia entre DCC y EDC¿Qué es la estequiometría composicional?
La estequiometría composicional es el análisis cuantitativo de un compuesto químico en términos de su composición atómica. Este término se refiere a los tipos de átomos y su número presentes en un compuesto químico específico. Podemos determinar esto a partir de la fórmula química del compuesto. La atomicidad de una molécula indica el número total de átomos presentes en un compuesto químico. Pero no hay detalles sobre los elementos químicos a los que pertenecen los átomos del compuesto y su número. A pesar de esto, podemos usar la estequiometría composicional de un compuesto dado para predecir su fórmula química. Por lo tanto, la estequiometría composicional es simplemente la composición química de una especie química.
Por ejemplo, la estequiometría de composición de una molécula de glucosa se da como seis átomos de carbono, doce átomos de hidrógeno y seis átomos de oxígeno. Por tanto, podemos afirmar que una molécula de glucosa contiene átomos de carbono, hidrógeno y oxígeno en la proporción 6:12:6. Esta es la estequiometría composicional de la glucosa.

 Diferencia entre el fluoruro de sodio y el monofluorofosfato de sodio.
Diferencia entre el fluoruro de sodio y el monofluorofosfato de sodio.Figura 01: Composición química de una molécula de glucosa.
Hay varias formas de determinar la estequiometría composicional de un compuesto desconocido. Las muestras del compuesto desconocido se pueden usar para determinar los tipos de elementos químicos en esa muestra junto con la masa de cada elemento. Luego, el número de moles de cada elemento por muestra se puede calcular utilizando estas masas. Los valores molares se pueden redondear para obtener la mejor relación posible entre los diferentes tipos de átomos en la muestra para predecir la fórmula molecular.
¿Qué es la estequiometría de reacción?
La estequiometría de reacción es la relación entre los reactivos y los productos de una reacción química particular. Este fenómeno es muy importante para equilibrar una reacción química, para determinar la relación entre los reactivos y cuánto producto podemos obtener de la reacción de estas especies.
Lectura relacionada: Diferencia entre lejía y desinfectante
Diferencia entre lejía y desinfectante
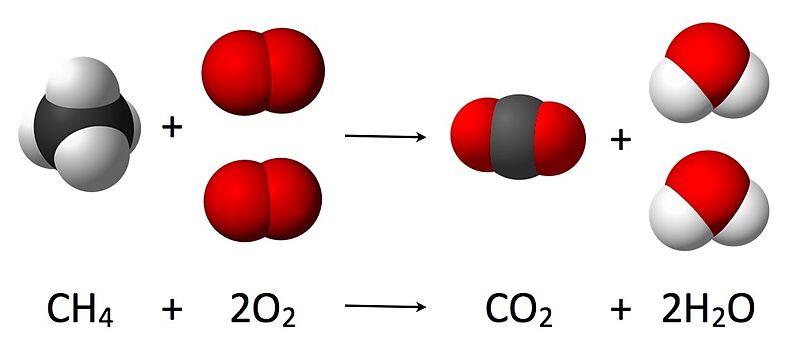
Figura 02: Un ejemplo de una estequiometría de reacción.
El concepto de estequiometría de reacción se basa en la ley de conservación de la masa, que establece que la masa total de los reactivos debe ser igual a la masa total de los productos, ya que la masa no se crea ni se destruye, solo se convierte en otras formas, como la energía.
Consideremos un ejemplo para comprender la teoría detrás de la estequiometría de reacción. La reacción entre un metal alcalino y el agua produce energía térmica, hidróxido del metal y gas hidrógeno. Los datos que conocemos son la masa de metal alcalino utilizada y la cantidad de agua utilizada para la reacción. Una vez completada la reacción, se puede recoger la cantidad de hidrógeno gaseoso y, utilizando su volumen, se pueden calcular los moles de hidrógeno gaseoso que se desprenden. Por lo tanto, suponiendo que todos los metales alcalinos reaccionan con el agua, podemos obtener la relación entre los reactivos y los productos involucrados en esta reacción. Esta es la estequiometría de reacción del metal alcalino en la reacción del agua.
¿Cuál es la diferencia entre la estequiometría composicional y la de reacción?
los diferencia principal entre la estequiometría de composición y de reacción es que la estequiometría de composición se refiere a la composición atómica de un compuesto químico, mientras que la estequiometría de reacción se refiere a la cantidad de compuestos consumidos o producidos durante una reacción química. Mientras que la estequiometría composicional indica la relación entre los átomos de cada elemento químico presente en un compuesto, la estequiometría de reacción indica la relación entre los reactivos y los productos involucrados en una reacción en particular.
Resumen: composición frente a estequiometría de reacción
La estequiometría es un método para analizar cuantitativamente un compuesto químico o una reacción química. los diferencia principal entre la estequiometría de composición y de reacción es que la estequiometría de composición se refiere a la composición atómica de un compuesto químico, mientras que la estequiometría de reacción se refiere a la cantidad de compuestos consumidos o producidos durante una reacción química.
Relación:
1. "Reacciones de estequiometría y equilibrio". Química LibreTextsLibretexts, 25 de septiembre de 2019, disponible aquí.
Imagen de cortesía:
1. "Beta-D-glucopiranosa" por NEUROtiker - Trabajo propio (Dominio público) a través de Commons Wikimedia
2. "Reacción de combustión del metano" Por JyntoRobert A. RohdeJacek FHJynto - (Dominio público) a través de Commons Wikimedia