¿Qué es el plomo?
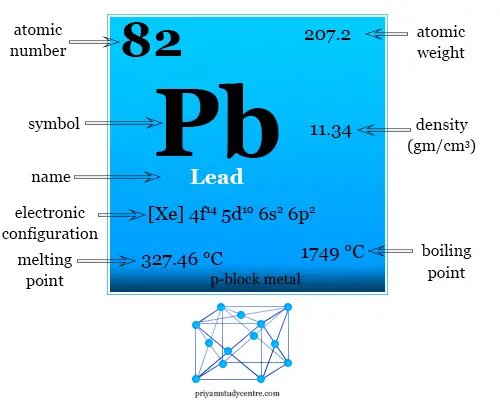
El plomo es un elemento químico o metal del grupo 14 de la tabla periódica con el símbolo PM y número atómico 82. Se ha utilizado en fontanería en la civilización romana. Ahora se ha detenido debido al envenenamiento por plomo.
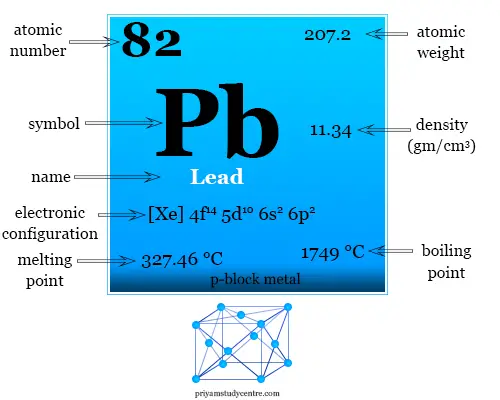
El plomo se utiliza para fabricar baterías y un agente antidetonante (tetraetilo de plomo) para combatir la contaminación del aire. Existe en una red cristalina empaquetada cerrada cúbica con una densidad de 11,34 g/cm3. El plomo es un metal post-transición suave y maleable.
Lectura relacionada: Galio: símbolo, propiedades, hechos y uso
Galio: símbolo, propiedades, hechos y usoEl bajo punto de fusión del plomo sugiere el hecho de que los cuatro electrones de valencia del Pb no participan en los enlaces metálicos. El número de oxidación +2 es común para el plomo en lugar de +4.
¿Dónde se encuentra el plomo?
Se encuentra en 13 a 16 ppm en la corteza terrestre. La galena (PbS) es la principal fuente de plomo metálico. Los otros minerales que contienen Pb(II) son la anglesita (PbSO4) y cerusita (PbCO3).
Estados Unidos, Rusia, Australia y Canadá son los principales productores de Pb metal. En la India, la galena contiene alrededor del 3 por ciento de Pb y una pequeña cantidad de Ag. Se obtiene de las minas Zawar en Udaipur en Rajasthan.
Lectura relacionada: Platino, Símbolo, Historia, Propiedades, Uso, Producción
Platino, Símbolo, Historia, Propiedades, Uso, ProducciónPropiedades del plomo
La química y las propiedades de los elementos del grupo 14 se derivan de su configuración electrónica. Todos los elementos tienen una capa cuántica externa con una s2pags2 configuración.
El plomo existe en una red cristalina compacta cúbica centrada en las caras con una densidad de 11,34 g/cm3. Es un metal de bajo punto de fusión porque no puede usar los cuatro electrones de valencia para la unión de metales.
| Guiar |
|||
| Símbolo | PM | ||
| Descubrimiento | Antiguo | ||
| Nombre derivado de | Palabra anglosajona para el metal, plomo. | ||
| isótopo común | 82PM208 | ||
| Propiedades periódicas | |||
| número atómico | 82 | ||
| Peso atomico | 207.2 | ||
| electrón por escala | 2, 8, 18, 32, 18, 4 | ||
| Configuración electrónica | [Xe] 4f14 5d10 6s2 6p2 | ||
| Grupo | 14 | ||
| Período de tiempo | 6 | ||
| Bloquear | bloque p | ||
| Características físicas | |||
| Condición a 20 °C | firma | ||
| Punto de fusion | 327,46 ºC | ||
| Punto de ebullición | 1749 ºC | ||
| Espesor | 11,34 g/cm3 | ||
| Capacidad calorífica molar | 26.650 J mol−1 k−1 | ||
| Resistencia eléctrica | 208nm | ||
| estructura cristalina | Cristal cúbico centrado en la cara | ||
| Propiedades químicas | |||
| Radio atómico (sin consolidar) | 2.02 | ||
| Radio covalente | 1.45 | ||
| Número de oxidación común | +2, +4 | ||
| Electronegatividad | 1.8 (escala de Pauling) | ||
| Afinidad electronica | 35,12 kJ mol−1 | ||
| Energía de ionización (kJ/mol) |
1º | 2do | 3ro |
| 715.6 | 1450.5 | 3081.5 | |
| número CAS | 7439-92-1 | ||
Plomo en la tabla periódica
El estaño se encuentra en el período 5 y el grupo 14 o la familia de carbonos de la tabla periódica.
Lectura relacionada: Molibdeno, Símbolo, Propiedades, Recursos, Uso
Molibdeno, Símbolo, Propiedades, Recursos, Uso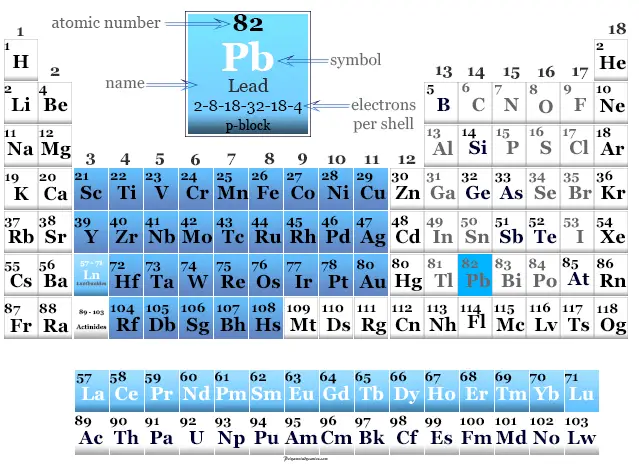
El plomo es un elemento del bloque p que se encuentra entre el estaño y el flerovio en la tabla periódica.
Datos sobre el plomo
- La reactividad química de los elementos del grupo 14, como el carbono, el silicio, el germanio, el estaño y el plomo, disminuye en el grupo.
- Los valores de potencial químico de Pb(II) a Pb son inferiores a los del hidrógeno, pero no pueden liberar hidrógeno de los ácidos.
- El polvo de plomo finamente dividido es de naturaleza pirofórica. Pero la superficie del metal está inactiva debido a la formación de la capa protectora de óxido.
- Se disuelve en ácido orgánico como el ácido acético o el ácido fórmico en presencia de aire.
- No se disuelve en ácido nítrico o sulfúrico concentrado debido a su recubrimiento insoluble.
Isótopos de metal
Por supuesto, el plomo tiene cuatro isótopos estables con números de masa 204, 206, 207 y 208. Tres de estos cuatro isótopos se encuentran en la serie de desintegración radiactiva. Es el primer elemento más pesado cuyos isótopos naturales son estables.
La abundancia relativa de estos isótopos se da debajo de la tabla,
| isótopo | Abundancia relativa |
| 204PM | 1,4 % |
| 206PM | 24,1% |
| 207PM | 22,1% |
| 208PM | 52,4% |
Extracción de galena
Galena se concentra por el proceso de flotación de espuma. El mineral concentrado se tuesta por el suministro limitado de aire para convertirlo parcialmente en PbO.
La autorreducción entre PbS y PbO sin cambios produce plomo metálico.
2 PbO + PbS → 3 Pb(l) + SO2 (gramo)
El metal bruto contiene muchas impurezas como Cu, Ag, Au, Zn, As, Sb y Sn. Se purifica por el proceso de electrólisis.
- El plomo impuro se incrusta en varillas para que sirvan como ánodo en una celda electroquímica.
- Se utiliza una placa de metal puro como cátodo en presencia de PbSiF6 electrólito. El electrolito se prepara por la acción del H2SiF6 en la tarde
- Las impurezas se arrojan al lodo del ánodo, mientras que más metal electropositivo, como el hierro, permanece en la solución.
Ingredientes químicos
A pesar de sus ns2 notario público2 configuración electrónica de la capa de valencia, los elementos más ligeros como el C o el Si del grupo 14 no tienen un compuesto divalente en condiciones normales.
Los valores de energía de enlace disminuyen significativamente en elementos más pesados como el Pb. Por lo tanto, los compuestos bivalentes son relativamente más estables a temperatura ambiente. La estabilidad de los hidruros del grupo 14 (MH4) disminuye de Ge a Pb debido a la disminución de la energía de enlace MH.
haluros
PbF sólido amarillo4 es el único tetrahaluro estable de Pb. Se descompone en PbF2 y F2 en calefacción. Puede prepararse por la acción del flúor o del HF sobre los compuestos de plomo. Otros tetrahaluros son menos estables y PbI4 no existe.
Los dihaluros de plomo son sólidos cristalinos estables que son ligeramente solubles en agua fría, pero mucho más solubles en agua tibia. PbCl2 y PbBr2 Radiación de espectro electromagnético de depósito sensible a la luz.
óxido de plomo
Óxido de Pb(II) o PbO2 es preparado por Pb. resolver3O4 en una solución diluida de ácido nítrico. Es un agente oxidante fuerte y se descompone en PbO a una temperatura superior a 300°C.
PbO es otro óxido de metal que viene en dos formas, litargirio y masicot.
- La forma Lithar se obtiene oxidando Pb fundido en aire por encima de 600°C en un horno de reverberación.
- Massicot se obtiene calentando Pb en aire.
El PbO es de naturaleza básica y se disuelve en ácidos para formar sales de Pb(II). Tiene una estructura de capas inusual en la que cuatro átomos de oxígeno forman una base de la pirámide cuadrada con metal Pb en la parte superior.
carbonato de plomo
El carbonato de plomo (II) se presenta en la naturaleza como cerusita con la fórmula química PbCO3. Se precipita a partir de Pb(NO3)2 solución por NaHCO3 a baja temperatura.
Se ha utilizado como pigmento blanco bajo el nombre de blanco-Pb. Pero ahora está siendo reemplazado muy rápidamente por TiO2 debido a la naturaleza no tóxica de TiO2.
Acetato de plomo
Acetato de Plomo o Pb (CH3ARRULLO)2 es un compuesto químico cristalino blanco con un sabor dulce. Se puede hacer hirviendo Pb con ácido acético y peróxido de hidrógeno.
Se utiliza en medicina para lavar el ojo. También se utiliza para fabricar otros compuestos de plomo y colorantes en el proceso de pintura.
uso de plomo
- Se utiliza en fontanería en la civilización romana. Ahora se ha detenido debido al envenenamiento por plomo.
- La producción mundial está aumentando debido al uso de baterías de Pb-ácido.
- Se ha utilizado para hacer aleaciones como soldaduras (50% Pb, 50% Sn) y metales (70 a 80% Pb, 30 a 15% Sb). Debido a su bajo punto de fusión y expansión en la solidificación de la aleación de Pb-Sb, se le llama tipo de metal.
- El plomo se utiliza para el revestimiento de cables y la fabricación de pigmentos.
- También se utiliza para almacenar líquidos corrosivos.
- Se utiliza para fabricar agentes antidetonantes como el tetraetilo de plomo. Pero la producción de tetraetilo de plomo está fuertemente desaconsejada debido a la contaminación del aire.