La electroforesis es un proceso químico en el que la carga eléctrica de una solución fluye hacia un electrodo opuesto. En la década de 1930, el biofísico sueco Arne Tisselius desarrolló la electroforesis mientras investigaba las proteínas de la sangre. En 1948, Arne Tisselius recibió el Premio Novel de Química por sus aportaciones a la técnica de la electroforesis.
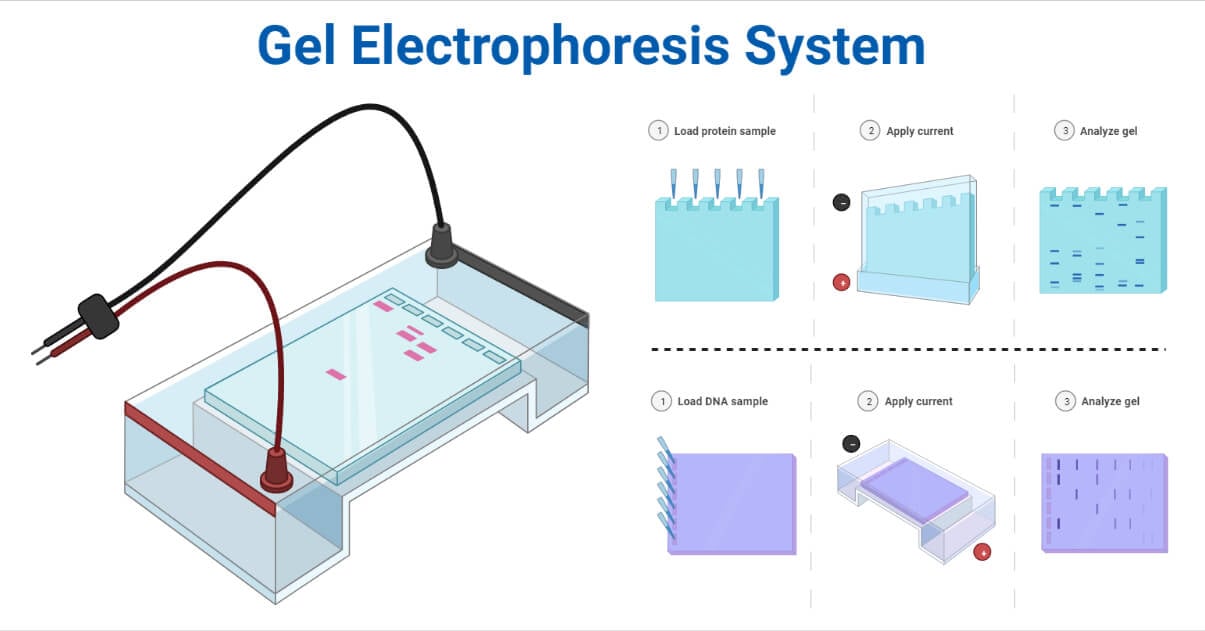
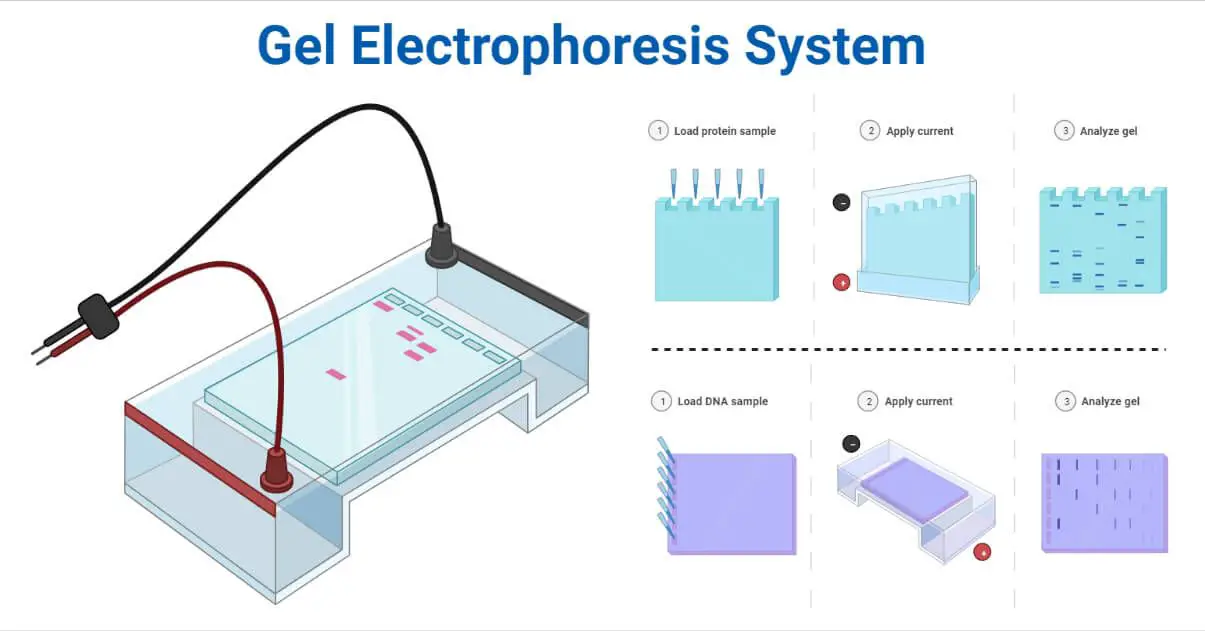
La electroforesis en gel es uno de los métodos de laboratorio para separar las moléculas de ADN, ARN o proteínas según su carga eléctrica o su tamaño.
- Principio de la electroforesis en gel
- Partes del aparato de electroforesis en gel
-
Tipos de electroforesis
- Electroforesis en gel de papel
- Electroforesis en gel de agarosa
- Electroforesis en gel de poliacrilamida (PAGE)
- Electroforesis en gel de campo pulsado (PFGE)
- Electroforesis en gel de poliacrilamida con dodecil sulfato de sodio (SDS-PAGE)
- Electroforesis en gel 2D
- Inmunoelectroforesis (electroforesis de cohete)
- Electroforesis diferencial en gel (DIGE)
- Procedimientos operativos de la electroforesis
- Aplicaciones de la electroforesis
- Beneficios de la electroforesis
- Límites de la electroforesis
- Precauciones que hay que tomar
- Ejemplos electroforesis Sistema
- Referencias
Principio de la electroforesis en gel
El principio de la electroforesis es la observación de que la mayoría de las biomoléculas existen como partículas cargadas eléctricamente con grupos funcionales ionizables. Una solución que contenga biomoléculas tendrá iones cargados positiva o negativamente en función del pH.
Lectura relacionada: Centrifugación - Principio, tipos y aplicaciones
Centrifugación - Principio, tipos y aplicacionesCuando las moléculas cargadas se colocan en un campo eléctrico, se mueven en la dirección opuesta al polo positivo o negativo. Dependiendo de la masa y la carga neta de cada partícula en la solución, las biomoléculas ionizadas migrarán a diferentes velocidades cuando se expongan a un campo eléctrico. Las partículas con carga negativa, como los ácidos nucleicos, gravitan hacia el ánodo, mientras que las partículas con carga positiva se desplazan hacia el cátodo. Cada partícula cargada migra según un patrón determinado por su propiedad particular debido a los cambios de velocidad y dirección, lo que permite la separación de componentes de biomoléculas con propiedades similares.
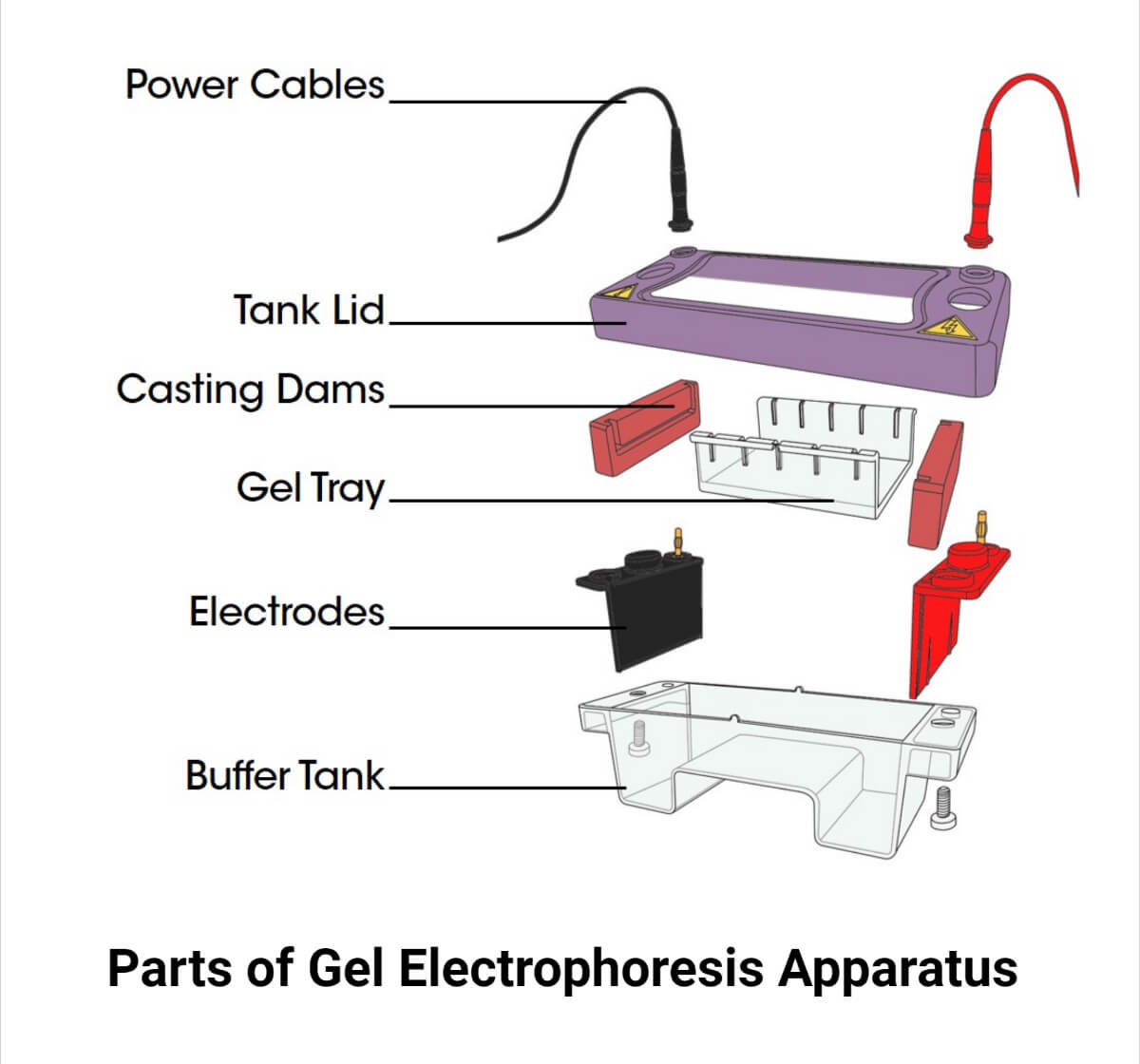
Partes del aparato de electroforesis en gel
Alimentación
- Las condiciones de la electroforesis son de corriente, tensión o potencia constantes.
- Debe utilizarse una fuente de alimentación constante para mantener el ritmo de migración.
- Los cables conductores rojo (ánodo/electrodo con carga positiva) y negro (cátodo/electrodo con carga negativa) conectan la fuente de alimentación a la caja de gel.
- Estos cables llevan la corriente eléctrica desde la fuente de alimentación hasta la caja de gel.
- Si la corriente aumenta, la resistencia produce más calor, lo que provoca una agitación térmica de los iones disueltos.
- El agua del equipo se evapora más rápidamente.
- La concentración de iones en el tampón aumentará por ello.
- Como el ADN y el ARN están cargados negativamente, el cable negro se une a la parte posterior de la caja, lo que les permite desplazarse hacia la parte delantera de la caja de gel, donde se une el cable rojo cargado positivamente.
Topes
- El tampón fija el pH del sistema y la carga eléctrica del soluto.
- El tampón ideal tiene las siguientes propiedades:
- Preserva la capacidad de disolución del analito
- Mantiene constante la capacidad de amortiguación durante todo el análisis
- No debe impedir la detección de los analitos objetivo.
- Conseguir el rango de separación adecuado
Hay dos tipos de tampones: un tampón ácido y un tampón básico. Para un pH más bajo, se utilizan tampones ácidos, como el citrato, el acetato, el formiato y el fosfato. Se utilizan tampones básicos como el tric, el borato y la tricina para mantener un pH elevado.
- La valencia (fuerza iónica) y la molalidad de los tampones son iguales. Por lo tanto, se componen de iones monovalentes.
- Los tampones preparados deben enfriarse cuidadosamente cuando no se utilicen, ya que pueden proporcionar un entorno favorable para el crecimiento bacteriano.
- Es posible utilizar el tampón frío en el procedimiento, ya que aumenta la resolución de la muestra y reduce la evaporación del disolvente.
- El tampón se puede reutilizar en volúmenes grandes hasta cuatro veces, pero en volúmenes más pequeños se puede desechar inmediatamente.
- Aunque existe un alto riesgo de dañar las sustancias químicas termolábiles debido al elevado calor creado, la mayor fuerza iónica del tampón es ventajosa para conseguir una resolución más nítida.
Medios de comunicación
- Los medios de soporte incluyen el almidón, la poliacrilamida, la agarosa y la membrana de acetato de celulosa en forma de lámina, placa y columna.
- Es un coloide que contiene más del 90% de agua.
- Sirve de tamiz molecular a través del cual se separan las moléculas.
- Las moléculas pequeñas pueden pasar a través de él porque es poroso, mientras que las moléculas más grandes no pueden.
- Se requiere neutralidad eléctrica.
- En la actualidad, el gel de agarosa se utiliza principalmente como soporte para la electroforesis.
- Gel de almidón
- Es el primer medio de gel utilizado para la electroforesis.
- Facilita la separación de las proteínas en función de la relación carga-masa y el tamaño molecular.
- Se preparó una suspensión coloidal hirviendo la suspensión de gránulos de almidón en un tampón; al dejarla enfriar, adopta la forma de un gel semisólido debido al entrelazamiento de las cadenas ramificadas de amilopectina.
- Se añade vaselina para evitar la hinchazón y la contracción.
- Se pueden conseguir zonas nítidas y un alto poder de resolución.
- Como la preparación del gel con reproducibilidad es difícil, no se utiliza actualmente.
- Acetato de celulosa
- Cuando Kohn demostró cómo separar la proteína hemoglobina presente en los glóbulos rojos e identificar la hemoglobina aberrante en el suero sanguíneo, se desarrolló la electroforesis de acetato de celulosa.
- Los papeles de filtro, compuestos totalmente de celulosa, se acetilan para producir acetato de celulosa. Los lugares C-3 y C-6 del anillo de la glucosa son generalmente donde se produce la acetilación. En comparación con otras matrices electroforéticas comunes, como la agarosa y la poliacrilamida, el acetato de celulosa tiene poros más grandes.
- Agarosa
- El agar aislado de las algas rojas contiene agarosa, un polímero lineal natural compuesto por cadenas de galactosa y 3,6-anhidrogalactosa.
- Al igual que el agar, la agarosa puede almacenarse como un polvo seco.
- El gel de agarosa se funde disolviendo el polvo de agarosa en el tampón de solución adecuado, calentándolo y dejándolo enfriar a temperatura ambiente.
- La concentración de agarosa en el tampón de la solución controla el tamaño del poro del gel.
- Para distinguir las moléculas de ADN y ARN, se suele utilizar el gel de agarosa a una concentración del 0,8% (p/v) al 5% (p/v).
- Resolución relativamente baja en comparación con los geles de poliacrilamida.
- Tiene una baja temperatura de gelificación, una carga neutra y forma geles estables. Por ello, se considera el material perfecto para la electroforesis en gel. Puede ser sólido o líquido.
- Poliacrilamida
- Es un gel claro y transparente formado por la copolimerización de monómeros de acrilamida en presencia del agente reticulante N, N-metileno-bis-acrilamida (también llamado "bis-acrilamida").
- La concentración de acrilamida, que debe ser proporcional a su agente de reticulación, controla el tamaño de los poros en los geles de poliacrilamida.
- La separación del ADN y las proteínas suele requerir una pequeña cantidad de gel de acrilamida (3%-15%).
- En la electroforesis en gel de poliacrilamida con dodecil sulfato sódico (SDS), las proteínas se separan en condiciones de desnaturalización del tamaño, en las que generalmente se utiliza un porcentaje mayor de gel de acrilamida (10%-20%).
Cámara de electroforesis
- Se trata de un recipiente o tanque de plástico lleno de un tampón para evitar el movimiento de las biomoléculas.
- Su tapa transparente facilita la visualización del proceso de migración.
- Se conecta a una fuente de alimentación.
Recipiente para el gel de tinción y desmanchado
- La tinción y la destinción del gel pueden realizarse con bandejas y contenedores.
- Hay cajas de formulario con tapa y abiertas.
- Suelen tener una base de propileno.
- Son transparentes y están bien ajustados.
- Son resistentes a los productos químicos y a las manchas.
Electrodos
- Los dos electrodos de platino ayudan a separar las moléculas por su capacidad de atraer cargas opuestas.
- Los iones positivos se unen a un ánodo, mientras que un cátodo une los iones negativos.
Peine de fundición y gel
- El gel se vierte en un molde de gel, que contiene el gel y se almacena dentro del aparato una vez que se ha disuelto en el disolvente.
- Los pocillos se colocan con un peine para prepararlos para la carga de la muestra.
Tipos de electroforesis
Existen varios tipos de electroforesis en gel, a saber
Lectura relacionada: HPLC- Definición, Principio, Partes, Tipos, Usos, Diagrama
HPLC- Definición, Principio, Partes, Tipos, Usos, Diagrama- Electroforesis en gel de papel
- Electroforesis en gel de agarosa
- Electroforesis en gel de poliacrilamida (PAGE)
- Electroforesis en gel de campo pulsado (PFGE)
- SDS- PÁGINA
- Electroforesis 2D
- Inmunoelectroforesis (electroforesis de cohete)
- Electroforesis diferencial en gel (DIGE)
También se clasifican en dos categorías: nativos y desnaturalizantes. En la electroforesis en gel nativo, el ARN o la proteína se mantienen en su estructura nativa al pasar por el gel. En cambio, en la electroforesis en gel desnaturalizante el ARN o la proteína se reducen a su estructura lineal antes o durante la electroforesis en gel. Esta reducción se consigue añadiendo un agente reductor a la muestra, al gel y/o al tampón, que separa los enlaces dentro de la molécula de ARN o de proteína y da lugar a la formación de una estructura secundaria.
Electroforesis en gel de papel
- Se utiliza para estudiar el suero y otros fluidos corporales en el ámbito clínico.
- No es transparente y no es tóxico
- Conveniente para almacenar
- Adsorción de proteínas
- Mala conductividad
- Tinción de fondo
- Los grupos OH de la celulosa se adhieren a las proteínas y ralentizan el movimiento electroforético, lo que provoca la formación de bandas y una mala resolución.
Electroforesis en gel de agarosa
- La concentración de agarosa determina la resolución de la electroforesis.
- Es adecuado para separar fragmentos de ADN de entre 100 pares de bases y 20 kilobases.
- Además, es aplicable a la separación electroforética de las proteínas.
- Cuando se utiliza una baja concentración de gel de agarosa, se puede utilizar para separar moléculas anfóteras según su punto isoeléctrico, lo que se denomina enfoque isoeléctrico.
Electroforesis en gel de poliacrilamida (PAGE)
- Se utiliza a una concentración de hasta el 3-30% (rango de pH: 4-9,0): la separación de proteínas requiere una concentración mayor que la de ADN, y viceversa.
- Un mayor grado de fiabilidad y una porosidad precisa.
- Su aplicación puede verse en el cálculo del peso molecular del ADN, la secuenciación del ADN, el estudio de la pureza del ADN, el análisis de las moléculas de ADN recombinante y la separación de las moléculas de ARN, y la medición del peso molecular del ARN.
Electroforesis en gel de campo pulsado (PFGE)
- En 1984, Shwartz y Cantor introdujeron este método.
- La separación del ADN en un gel de agarosa se consigue cambiando la dirección y la fuerza del campo eléctrico entre los electrodos.
- Con esta técnica se separa el ADN de alto peso molecular con varias megabases o incluso cromosomas enteros.
- La PFGE se utiliza en muchos campos porque produce resultados precisos y eficientemente reproducibles.
- Se aplica en los estudios sobre la biología molecular de los patógenos alimentarios, el control de la estabilidad genética de los organismos utilizados en el proceso de fermentación, las aplicaciones cartográficas como la detección de reordenamientos cromosómicos, el RFLP y la huella de ADN, y la identificación de cepas relacionadas en caso de brotes en los hospitales, etc.
Electroforesis en gel de poliacrilamida con dodecil sulfato de sodio (SDS-PAGE)
- Originalmente se llamaba método Laemmli, por su inventor británico U.K. Laemmli.
- El gel de apilamiento superior tiene poros más grandes con un pH de 6,8, y el gel de separación inferior tiene poros más pequeños con un pH de 8.
- Las proteínas se separan según la longitud de la cadena polipeptídica en el SDS-PAGE, que elimina en gran medida la influencia de la estructura y la carga mediante el uso de dodecil sulfato de sodio (SDS, también conocido como lauril sulfato de sodio) y el gel de poliacrilamida.
- El SDS, un detergente del tampón de la muestra, y ciertas sustancias químicas reductoras actúan conjuntamente para dañar la estructura terciaria de las proteínas al romper sus enlaces disulfuro.
- Se utiliza para calcular el peso molecular de la proteína y determinar si las muestras de proteínas son puras o no.
Punto isoeléctrico y enfoque isoeléctrico (IEF)
El nivel de pH conocido como punto isoeléctrico es donde las proteínas no tienen carga neta (pI). Las proteínas se separan por sus puntos isoeléctricos en un gradiente de pH continuo mediante el enfoque de alta resolución conocido como enfoque isoeléctrico (IEF). Se pueden separar compuestos con un pI que sólo difiere en 0,01 unidades de pH gracias a su excelente poder de resolución.
Lectura relacionada: Mechero de Bunsen: Partes, Usos, Tipos
Mechero de Bunsen: Partes, Usos, TiposSe utiliza para distinguir las isoenzimas, fraccionar las proteínas y separar todas las sustancias anfóteras.
Electroforesis en gel 2D
- Se utiliza para analizar mezclas complicadas de proteínas y se creó como un híbrido de los procedimientos 2DGel, IEF y SDS-PAGE.
- El IEF separa la proteína según sus cargas en el primer paso y luego según su masa en el segundo.
- El tratamiento con SDS hace que la proteína separada en el gel IEF se cargue negativamente, y la electroforesis se realiza colocando el gel en posición horizontal dentro del gel SDS-PAGE.
- Por lo tanto, las proteínas que se concentran en el pI se dividen según su peso molecular.
Inmunoelectroforesis (electroforesis de cohete)
- En el proceso de inmunoelectroforesis (IEP), se utiliza primero la electroforesis para separar el antígeno proteico en un medio semisólido, seguido de una inmunodifusión contra el antisuero que da lugar a la creación de la precipitina.
- Los anticuerpos adecuados complementarios al antígeno que se va a medir se disuelven en una solución de agar fundido y se colocan en una placa horizontal. Los antígenos se inyectan en pozos perforados en el agar. La Ag adquiere una carga negativa a pH alcalino, se desplaza en dirección al ánodo, interactúa con el Ab para formar el complejo Ag-Ab y precipita. Los inmunoprecipitados aparecen entonces en forma de arcos como cohetes una vez teñido el gel con un colorante adecuado, como el CBB.
Electroforesis diferencial en gel (DIGE)
- Se creó para abordar el elemento cuantitativo de las investigaciones de expresión diferencial y para aliviar algunos de los problemas de la PAGE 2D, como las fluctuaciones analíticas.
- Para ver cada muestra de proteína por separado, se pueden etiquetar hasta tres muestras de proteína diferentes con tintes fluorescentes de tamaño y carga coincidentes (por ejemplo, Cy3, Cy5, Cy2). Las tres muestras se combinan, se cargan y se someten a electroforesis 2D.
Procedimientos operativos de la electroforesis
Preparación de la solución de gelSe prepara un gel disolviéndolo en agua hirviendo. Tras enfriar a una temperatura más cómoda, la solución se vierte en un molde o colada.
Fundición en gelSe utiliza un peine para crear pozos en el gel una vez fijado. A continuación, se introduce el gel en la cámara de electroforesis. El tampón llena la cámara hasta un máximo de un tercio de su volumen total.
Preparación de la muestraPara dar color y densidad a la muestra, se añade un colorante de carga, que puede ser una etiqueta fluorescente o bromuro de etidio.
El ADN se aísla y se somete a un tratamiento previo, y luego se coloca en una solución con un colorante azul básico para ayudar a visualizar el movimiento de la muestra en el gel.
Muestra de cargaPara cargar la muestra en los pocillos, se utiliza una propieta limpia.
ElectroforesisElectroforesis: La cámara y una fuente de alimentación en la que se regula la tensión están conectadas por los cables negativo y positivo, respectivamente. El campo eléctrico y las partículas cargadas negativamente se crean cuando se enciende la fuente de alimentación. El ADN cargado negativamente migra hacia el ánodo, ya que las moléculas gravitan hacia los electrodos con cargas opuestas.
Detención de la electroforesis, tinción y visualizaciónEl colorante se utiliza para controlar visualmente la migración. La fuente de alimentación está desconectada. El gel se tiñe y se visualiza mediante un generador de imágenes de gel una vez finalizado el procedimiento. Al comparar el tamaño de los fragmentos de la muestra con el estándar, se utiliza el logaritmo del peso molecular para calcular sus tamaños.
Aplicaciones de la electroforesis
- La huella de ADN se utiliza para separar fragmentos de ADN para la investigación de la escena del crimen y las pruebas de paternidad.
- Detección de variaciones genéticas y proteínas implicadas en la salud y la enfermedad.
- Se utiliza en la detección y purificación de ácidos nucleicos y proteínas con fines científicos.
- Se utiliza para encontrar patógenos en la sangre, en otros tejidos o en fuentes como los alimentos.
- Facilita la identificación y la purificación de proteínas o ácidos nucleicos que, con frecuencia, se examinan con más detalle mediante la espectrometría de masas o la secuenciación del ADN.
- Se utiliza en los métodos de blotting para analizar las macromoléculas y en los estudios evolutivos.
- Facilita la evaluación de los resultados de la reacción en cadena de la polimerasa (PCR).
- Tanto el desarrollo como la fabricación de vacunas se benefician de la electroforesis.
- Para diferenciar las especies y las relaciones evolutivas, se realiza un perfil taxonómico de ADN.
Beneficios de la electroforesis
- Un precio razonable.
- Establece una relación directa entre resultados similares
- Bastante fácil de hacer
- Puede analizar el ADN de cualquier tipo de prueba.
- Mayor resolución
- Disponible en una amplia gama de tamaños de poros.
- Estable en una amplia gama de pH, temperatura y fuerza iónica.
- Transparente a la luz
- Químicamente inerte
- Neutralidad eléctrica e hidrofilia
Límites de la electroforesis
1. Análisis limitado de las muestras
- La expresión génica puede examinarse en cada pequeña localización de una muestra de tejido mediante métodos como la hibridación in situ (ISH).
- Con la ISH, los investigadores pueden examinar todas las regiones del cerebro de una muestra, mientras que los métodos de electroforesis sólo pueden hacerlo para un número limitado de regiones.
2. Las medidas no son exactas
- La electroforesis en gel puede separar eficazmente las proteínas de peso molecular similar mediante Western blot.
- También puede separar las proteínas con mayor precisión mediante un método llamado electroforesis 2D.
- La espectroscopia de masas debe utilizarse después de la purificación de la proteína para determinar la masa exacta de las proteínas.
3. Se necesita una gran muestra inicial
- No es posible amplificar las proteínas como se hace con el ADN y el ARN antes de la electroforesis. Por lo tanto, se necesita una muestra de tejido bastante grande para realizar estas pruebas, lo que reduce la utilidad de la técnica. La citometría de flujo y la inmunohistoquímica se utilizan con frecuencia para analizar la expresión de proteínas en células individuales.
4. Facilidad de visualización limitada
- La electroforesis es ineficaz para medir pequeñas hormonas, neurotransmisores e iones.
- Debido a dos problemas, no reaccionan completamente a la preparación de electroforesis (comúnmente llamada SDS-PAGE), e incluso si lo hicieran, son demasiado pequeños para separarse adecuadamente. Se precipitarían en el fondo del gel.
5. Flujo bajo
- Bajo rendimiento en el sentido de que no genera datos muy rápidamente. En comparación con la PCR y la citometría de flujo, que son procesos masivamente paralelos y en serie, la electroforesis es inferior para generar datos de investigación y crear relaciones complejas.
Precauciones que hay que tomar
- Es aconsejable utilizar suelos y bancos no conductores (de madera o plástico).
- Evita los puntos de conexión a tierra y los conductores involuntarios (como fregaderos y otras fuentes de residuos) cuando trabajes alrededor o cerca de un sistema de electroforesis.
- Evita empujar con fuerza mientras cargas las muestras, ya que esto puede destruir los pocillos.
- Utiliza guantes, mascarilla y gafas durante la preparación del gel.
- El EtBr es cancerígeno y mutagénico, así que toma precauciones antes de manipularlo.
Ejemplos electroforesis Sistema
Sistema de electroforesis de ADN GEP-TH-1000TBT (Fabricante: Bioevopeak)
Características
- El sistema tiene una fuente de energía de alta corriente integrada que puede lograr una alta eficiencia y una rápida transferencia controlando directamente la corriente entre el ánodo de titanio y el cátodo de acero inoxidable.
- El sistema de transferencia integra perfectamente las tecnologías de transferencia convencionales, permitiendo la transferencia más rápida y eficaz de las proteínas del gel a la membrana.
Sistema de electroforesis electrofocal BT105 (Fabricante: G BIOSCIENCES)
Características
- Elimina los problemas de fuga de gel; no se necesita cinta adhesiva.
- Hay dos peines disponibles para pozos pequeños y grandes.
- Se suministra con una fuente de alimentación seleccionable.
- Fácil de usar y ligero.
Sistema de electroforesis de ADN EPS-2014 (Fabricante: INOVIALAB)
Características
- El minisistema de electroforesis EPS-2014 es un diseño compacto e inteligente específico para la electroforesis de ADN y ARN.
- Gracias a un sensor magnético, la corriente sólo puede fluir hacia los electrodos cuando la tapa está abierta.
- Cuando se retira la tapa o se abre mientras el sistema está en funcionamiento, la corriente se corta rápidamente.
Sistema de electroforesis de enfoque isoeléctrico SymphonyIEF (Fabricante: Hercuvan)
Características
- Una máquina versátil llamada SymphonyIEF Isoelectric Focusing puede satisfacer la mayoría de las necesidades de IEF, desde operaciones a pequeña escala hasta de alto rendimiento.
- Funciona con geles horizontales prefabricados de IEF y PAGE cuando el marco del electrodo se fija directamente a la placa de refrigeración.
Referencias
- Viswanathan, S., Unlü, M., y Minden, J. S. (2006). Electroforesis en gel de diferencia bidimensional. Nature Protocols, 1(3), 1351-1358. https://doi.org/10.1038/nprot.2006.234
- Büyükköroğlu, G., Dora, D. D., Özdemir, F., & Hızel, C. (2018). Técnicas de análisis de proteínas. Tecnologías ómicas y bioingeniería, 317-351. doi:10.1016/b978-0-12-804659-3.00015-4
- https://javalab.org/en/dna-electrophoresis/
- https://conductscience.com/introduction-to-electrophoresis/
- https://study.com/learn/lesson/agarose-gel-electrophoresis-steps-purpose.html
- https://www.vedantu.com/biology/sds-page
- https://uomustansiriyah.edu.iq/media/lectures/6/6_2021_09_15!11_46_27_PM.docx
- https://sciencing.com/disadvantages-gel-electrophoresis-8003362.html
- https://www.medicalexpo.com/prod/hercuvan/product-113272-925705.html
- https://www.medicalexpo.com/prod/g-biosciences/product-301595-1013667.html
- https://www.medicalexpo.com/prod/inovialab/product-130336-1026357.html
- https://www.medicalexpo.com/prod/bioevopeak/product-301335-1060455.html