La ecuación de Nernst se usa para calcular el voltaje de una celda electroquímica o para encontrar la concentración de uno de los componentes de la celda.
La Ecuación de Nernst
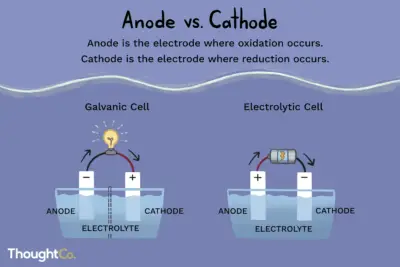
La ecuación de Nernst relaciona el potencial celular en equilibrio (también llamado potencial de Nernst) con su gradiente de concentración a través de una membrana. Se formará un potencial eléctrico si hay un gradiente de concentración para el ion a través de la membrana y si existen canales de iones selectivos de modo que el ion pueda cruzar la membrana. La relación se ve afectada por la temperatura y si la membrana es más permeable a un ion sobre otros.
Lectura relacionada: Qué Es la Galvanoplastia y Cómo Funciona?
Qué Es la Galvanoplastia y Cómo Funciona?
La ecuación se puede escribir:
Ecélula = E0célula - (RT / nF) lnQ
Ecélula = potencial celular en condiciones no estándar (V)
E0célula = potencial celular en condiciones estándar
R = constante de gas, que es 8,31 (voltio-culombio) / (mol-K)
T = temperatura (K)
n = número de moles de electrones intercambiados en la reacción electroquímica (mol)
F = Constante de Faraday, 96500 culombios / mol
Q = cociente de reacción, que es la expresión de equilibrio con concentraciones iniciales en lugar de concentraciones de equilibrio
 ¿Qué Es un Cóctel Molotov?
¿Qué Es un Cóctel Molotov?
A veces es útil expresar la ecuación de Nernst de manera diferente:
Ecélula = E0célula - (2.303 * RT/nF)logQ
en 298K, Ecélula = E0célula - (0,0591 V / n)log Q
Lectura relacionada: De Qué Está Hecho El Fuego? Composición Química
De Qué Está Hecho El Fuego? Composición Química
Ejemplo de Ecuación de Nernst
Se sumerge un electrodo de zinc en un ácido de Zn 0,80 M2+ solución que está conectada por un puente salino a un Ag de 1,30 M+ solución que contiene un electrodo de plata. Determine el voltaje inicial de la celda a 298K.
A menos que haya memorizado seriamente, deberá consultar la tabla de potencial de reducción estándar, que le dará la siguiente información:
E0rojo: Zn2+aq + 2e- → Zns = -0,76 V
E0rojo: Ag+aq + e- → Ags = + 0,80 V
Ecélula = E0célula - (0,0591 V / n)log Q
Q = [Zn2+]/[Ag+]2
La reacción procede espontáneamente de modo que E0 es positivo. La única forma de que esto ocurra es si el Zn se oxida (+0,76 V) y la plata se reduce (+0,80 V). Una vez que se da cuenta de eso, puede escribir la ecuación química equilibrada para la reacción celular y puede calcular E0:
Zns → Zn2+aq + 2e- y E0buey = + 0,76 V
2Ag+aq + 2e- → 2Ags y E0rojo = + 0,80 V
que se suman para producir:
Zns + 2Ag+aq → Zn2+a + 2Ags con E0 = 1,56 V
Ahora, aplicando la ecuación de Nernst:
Q = (0,80)/(1,30)2
Q = (0,80)/(1,69)
Q = 0,47
E = 1,56 V - (0,0591 / 2)log (0,47)
E = 1,57 V