- ¿Qué es la cromatografía de afinidad?
- Principio de la cromatografía de afinidad
- Componentes de la cromatografía de afinidad
- Pasos en Cromatografía de afinidad
- Aplicaciones de la cromatografía de afinidad
- Ventajas de la cromatografía de afinidad
- Limitaciones de la cromatografía de afinidad
- Referencias
¿Qué es la cromatografía de afinidad?
- La cromatografía es una importante técnica biofísica que permite la separación, identificación y purificación de los componentes de una mezcla para su análisis cualitativo y cuantitativo.
- Es una técnica de separación en la que se hace que una fase móvil que lleva una mezcla se mueva en contacto con una fase estacionaria selectivamente absorbente.
- La cromatografía de afinidad es un tipo de líquido cromatografía para la separación, purificación o análisis específico de los componentes de la muestra.
- Utiliza la interacción biológica reversible o el reconocimiento molecular llamado afinidad, que se refiere a la atracción ejercida en diferentes grados entre los átomos que los hace permanecer en combinación.
Ejemplo: Enzima con un inhibidor, antígeno con un anticuerpo, etc.
- Fue descubierto por Pedro Cuatrecasas y Meir Wilcheck.
Principio de la cromatografía de afinidad
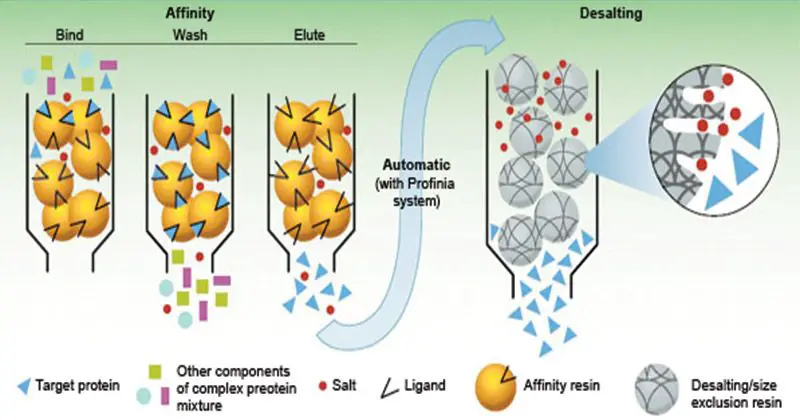
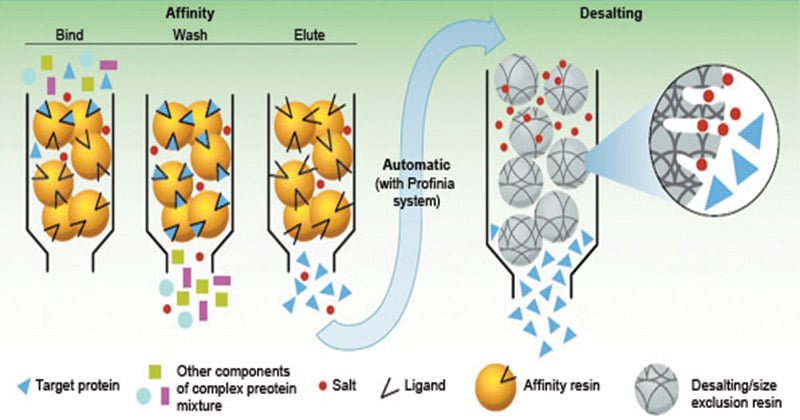
- La fase estacionaria consiste en un medio de soporte, sobre el que se une covalentemente el sustrato (ligando), de forma que quedan expuestos los grupos reactivos esenciales para la unión de la molécula objetivo.
- Al pasar la mezcla cruda de las sustancias por la columna cromatográfica, las sustancias con sitio de unión para el sustrato inmovilizado se unen a la fase estacionaria, mientras que todas las demás sustancias se eluyen en el volumen vacío de la columna.
- Una vez eluidas las demás sustancias, las moléculas objetivo unidas pueden ser eluidas por métodos como la inclusión de un ligando competidor en la fase móvil o el cambio de las condiciones de pH, fuerza iónica o polaridad.
Componentes de la cromatografía de afinidad
1. Matriz
- La matriz es un soporte inerte al que se puede acoplar directa o indirectamente un ligando.
- Para que la matriz sea eficaz debe tener ciertos caracteres:
- La matriz debe ser química y físicamente inerte.
- Debe ser insoluble en los disolventes y tampones empleados en el proceso
- Debe ser química y mecánicamente estable.
- Debe acoplarse fácilmente a un ligando o a un brazo espaciador en el que se pueda fijar el ligando.
- Debe presentar buenas propiedades de fluidez y tener una superficie relativamente grande para su fijación.
- Los materiales de matriz más útiles son la agarosa y la poliacrilamida.
2. Brazo espaciador
- Se utiliza para mejorar la unión entre el ligando y la molécula diana, superando los efectos del impedimento estérico.
3. Ligando
- Se refiere a la molécula que se une de forma reversible a una molécula objetivo específica.
- El ligando sólo puede seleccionarse cuando se conoce la naturaleza de la macromolécula que se va a aislar.
- Cuando hay que purificar una proteína receptora de hormonas por cromatografía de afinidad, la propia hormona es un candidato ideal para el ligando.
- Para el aislamiento de anticuerpos, se puede utilizar un antígeno o hapteno como ligando.
- Si se va a purificar una enzima, se puede utilizar un análogo del sustrato, un inhibidor, un cofactor o un efector como ligando inmovilizado.
Pasos en Cromatografía de afinidad
- El medio de afinidad se equilibra en tampón de unión.
- La muestra se aplica en condiciones que favorecen la unión específica de la(s) molécula(s) diana a una sustancia de unión complementaria (el ligando). Las sustancias diana se unen específicamente, pero de forma reversible, al ligando y el material no unido se lava a través de la columna.
- La elución se realiza de forma específica, utilizando un ligando competitivo, o no específica, cambiando el pH, la fuerza iónica o la polaridad. La proteína objetivo se recoge en una forma purificada y concentrada.
- El medio de afinidad se reequilibra con tampón de unión.
Estos acontecimientos pueden resumirse en los tres pasos principales siguientes:
Lectura relacionada: Electroforesis en gel de agarosa - Definición, principio, partes, pasos, aplicaciones
Electroforesis en gel de agarosa - Definición, principio, partes, pasos, aplicaciones1. Preparación de la columna
- La columna se carga con un soporte sólido como la sefarosa, la agarosa, la celulosa, etc.
- El ligando se selecciona en función del aislamiento deseado.
- El brazo espaciador se coloca entre el ligando y el soporte sólido.
2. Carga de la muestra
- La solución que contiene una mezcla de sustancias se vierte en la columna de elución y se deja correr a un ritmo controlado.
3. Elución del complejo ligando-molécula
- La sustancia objetivo se recupera cambiando las condiciones para favorecer la elución de las moléculas unidas.
Aplicaciones de la cromatografía de afinidad
- La cromatografía de afinidad es uno de los métodos más útiles para la separación y purificación de productos específicos.
- Es esencialmente una técnica de purificación de muestras, utilizada principalmente para moléculas biológicas como las proteínas.
Su principal aplicación es:
- Separación de mezclas de compuestos.
- Eliminación de impurezas o en proceso de purificación.
- En los ensayos enzimáticos
- Detección de sustratos
- Investigación de los sitios de unión de las enzimas
- En las reacciones antígeno-anticuerpo in vitro
- Detección de polimorfismos y mutaciones de nucléotidos simples en ácidos nucleicos
Ventajas de la cromatografía de afinidad
- Alta especificidad
- Las moléculas objetivo pueden obtenerse en un estado altamente puro
- Purificación en un solo paso
- La matriz puede reutilizarse rápidamente.
- La matriz es un sólido que puede lavarse y secarse fácilmente.
- Da un producto purificado con alto rendimiento.
- La cromatografía de afinidad también puede utilizarse para eliminar contaminantes específicos, como las proteasas.
Limitaciones de la cromatografía de afinidad
- Método que requiere mucho tiempo.
- Se necesitan más cantidades de disolventes que pueden ser caros.
- Trabajo intenso
- La adsorción no específica no puede eliminarse totalmente, sólo puede minimizarse.
- Disponibilidad limitada y coste elevado de los ligandos inmovilizados.
- Las proteínas se desnaturalizan si no se ajusta el pH necesario.
Referencias
- Wilson, K., Walker, J. (2018). Principios y Técnicas de Bioquímica y Biología Molecular (8 eds.). Cambridge University Press: Nueva York.
- https://www.med.unc.edu/pharm/sondeklab/files/resource-files/protein-purification-handbooks/Affinity%20chromatography.pdf
- https://www.slideshare.net/poojakamble1609/affinity-chromatography-ppt
- https://www.sigmaaldrich.com/content/dam/sigmaaldrich/docs/promo_NOT_INDEXED/General_Information/1/ge-affinity-chromatography.pdf
- https://www.slideshare.net/sagarsavale1/affinity-chromatography-56328075
- https://www.shodex.com/en/da1/09/0201.html
- https://www.slideshare.net/asimsami/affinity-chromatography-73800707