Que Diferencia clave entre el alosterismo positivo y negativo es que el alosterismo positivo en las proteínas muestra una alta afinidad por los ligandos, mientras que el alosterismo negativo en las proteínas muestra una baja afinidad por los ligandos.
Lectura relacionada: ¿Cuál es la diferencia entre Hydroxyzine HCL y Hydroxyzine Pamoate?
¿Cuál es la diferencia entre Hydroxyzine HCL y Hydroxyzine Pamoate?El alosterismo o comportamiento alostérico es el fenómeno por el cual la actividad de una proteína puede alterarse en respuesta a la unión de algunas moléculas en un sitio diferente al sitio activo de la proteína (particularmente en enzimas). El alosterismo positivo indica que la unión de una molécula efectora a una enzima hace que la enzima cambie de configuración a una forma activa. Por el contrario, el alosteirismo negativo indica que la unión de la molécula efectora hace que la enzima cambie su configuración de una forma activa a una forma inactiva.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es el alosterismo positivo?
3. ¿Qué es el alosterismo negativo?
4. Alosterismo positivo vs. negativo en forma tabular
5. Resumen: alosterismo positivo frente a negativo
¿Qué es el alosterismo positivo?
El alosterismo positivo es el cambio en la configuración de una proteína (generalmente una enzima) de una forma inactiva a una forma activa tras la unión de una molécula efectora. La molécula efectora se une a un sitio distinto del sitio activo de la enzima; se llama sitio alostérico. Este proceso también se conoce como activación alostérica.
Lectura relacionada: ¿Cuál es la diferencia entre el cobalto y el litio?
¿Cuál es la diferencia entre el cobalto y el litio?Un ejemplo común de dicha unión de moléculas efectoras es la unión de una molécula de oxígeno a una molécula de hemoglobina, que activa la molécula de hemoglobina para transportar eficazmente oxígeno a las células. Allí, la molécula de oxígeno se combina con el hierro ferroso de una molécula de hemo en la molécula de hemoglobina. La forma activa se conoce como oxihemoglobina, mientras que la forma inactiva se conoce como desoxihemoglobina.
¿Qué es el alosterismo negativo?
El alosterismo negativo es el cambio en la configuración de una enzima de una forma activa a una forma inactiva tras la unión de una molécula efectora. La molécula efectora se une a un sitio distinto del sitio activo de la enzima; se llama sitio alostérico. Este proceso también se conoce como inhibición alostérica.
 Lectura relacionada:
Lectura relacionada: ¿Cuál es la diferencia entre el alcohol desnaturalizado y el alcohol quirúrgico?
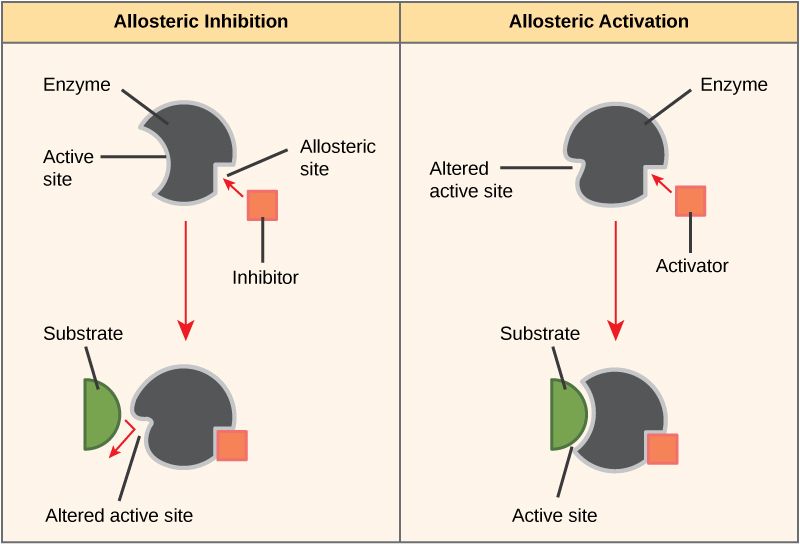
¿Cuál es la diferencia entre el alcohol desnaturalizado y el alcohol quirúrgico?Figura 01: Alosterismo positivo y negativo.
Durante la alosteria negativa, la unión de un ligando disminuye la afinidad de la enzima por el sustrato en los otros sitios activos disponibles para la unión del sustrato. Un ejemplo es la unión de 2,3-BPG a un sitio alostérico de la hemoglobina, lo que provoca una disminución de la afinidad por el oxígeno de todas las subunidades.
¿Cuál es la diferencia entre alosterismo positivo y negativo?
En el alosterismo positivo, la unión de una molécula efectora a una enzima hace que la enzima cambie de configuración a una forma activa, mientras que en el alosterismo negativo, la unión de una molécula efectora hace que la enzima cambie de configuración de la forma activa a la forma inactiva. La diferencia clave entre el alosterismo positivo y negativo es que el alosterismo positivo en las proteínas muestra una alta afinidad por los ligandos, mientras que el alosterismo negativo en las proteínas muestra una baja afinidad por los ligandos. Además, el alosterismo positivo implica activación, mientras que el alosterismo negativo implica inhibición. La unión de oxígeno a la hemoglobina es un ejemplo de alosterismo positivo, mientras que la unión de 2,3-BPG a la hemoglobina es un ejemplo de alosterismo negativo.
La siguiente infografía presenta la diferencia entre el alosterismo positivo y negativo en forma tabular para una comparación directa.
Resumen: alosterismo positivo versus negativo
En el alosterismo, o comportamiento alostérico, la actividad de una proteína puede verse alterada dependiendo de la unión de algunas moléculas en un sitio diferente al sitio activo de la proteína (particularmente en enzimas). La diferencia clave entre el alosterismo positivo y negativo es que el alosterismo positivo en las proteínas muestra una alta afinidad por los ligandos, mientras que el alosterismo negativo en las proteínas muestra una baja afinidad por los ligandos.
Relación:
1. "3.6: Interacciones alostéricas". Química LibreTextsLetra libre, 17 de julio de 2020.
Imagen de cortesía:
2. "Figura 06 05 05 - Activación e inhibición alostérica" por CNX OpenStax - (CC BY 4.0) a través de Commons Wikimedia