
Que Diferencia clave entre el amoníaco y el trifluoruro de boro es que el amoníaco es una molécula polar mientras que el trifluoruro de boro es una molécula no polar.
Lectura relacionada: ¿Cuál es la diferencia entre los hidrocarburos de cadena abierta y los de cadena cerrada?
¿Cuál es la diferencia entre los hidrocarburos de cadena abierta y los de cadena cerrada?El amoníaco y el trifluoruro de boro tienen una atomicidad similar y una conectividad de átomos muy similar, pero hay un par de electrones solitarios en el átomo de nitrógeno en la molécula de amoníaco, mientras que no hay electrones solitarios en el átomo de boro en el trifluoruro de boro. Este hecho hace que el amoníaco sea una molécula polar y el trifluoruro de boro una molécula no polar.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es el amoníaco?
3. ¿Qué es el trifluoruro de boro?
4. Amoníaco versus trifluoruro de boro en forma tabular
5. Resumen
¿Qué es el amoníaco?
El amoníaco es un compuesto inorgánico con la fórmula química NH3. Es una sustancia gaseosa y el hidruro de pnictógeno más simple. El amoníaco se presenta como un gas incoloro con un olor acre e irritante. El nombre IUPAC del amoníaco es azán. La masa molar del amoníaco es 17,03 g/mol. Su punto de fusión es de -77,73 °C y su punto de ebullición es de -33,34 °C.
Lectura relacionada: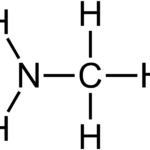 ¿Cuál es la diferencia entre la etanamida y la metilamina?
¿Cuál es la diferencia entre la etanamida y la metilamina?Cuando se considera la presencia de gas amoníaco, se encuentra de forma natural en el medio ambiente, pero en pequeñas cantidades como producto de materia animal y vegetal nitrogenada. A veces también encontramos amoníaco en el agua de lluvia. En nuestro cuerpo, los riñones excretan amoníaco para neutralizar el exceso de ácido.
La estructura química de la molécula de amoníaco consta de un átomo de nitrógeno unido a tres átomos de hidrógeno. Dado que hay cinco electrones en la capa de electrones más externa del nitrógeno, hay un par de electrones solitario en el átomo de nitrógeno de la molécula de amoníaco. Por lo tanto, la geometría de la molécula de amoníaco es trigonal-piramidal. Además, podemos licuar fácilmente este compuesto. Esto se debe a que puede formar enlaces de hidrógeno entre las moléculas de amoníaco, ya que también hay enlaces NH y pares de electrones solitarios.
¿Qué es el trifluoruro de boro?
El trifluoruro de boro es un compuesto inorgánico con la fórmula química BF3. Es un gas picante que es incoloro y tóxico. Puede formar humos blancos en el aire húmedo. Sin embargo, hay dos formas principales de trifluoruro de boro como forma anhidra y forma dihidratada; La forma anhidra es un gas incoloro, mientras que la forma dihidratada es un líquido incoloro. Considerando su solubilidad en agua, la forma anhidra tiende a descomponerse exotérmicamente cuando se agrega al agua, mientras que la forma dihidratada es altamente soluble en agua. Esta sustancia es corrosiva, por lo que debemos utilizar acero inoxidable, monel y hastelloy para el almacenamiento de esta sustancia.

Figura 02: trifluoruro de boro
La molécula de trifluoruro de boro tiene una geometría plana trigonal. Debido a su simetría, no tiene momento dipolar. Esta molécula es isoelectrónica con el anión carbonato. En general, nos referimos al trifluoruro de boro como una especie química deficiente en electrones. Tiene una reactividad exotérmica con bases de Lewis.
En la síntesis del trifluoruro de boro, podemos producirlo a partir de la reacción entre los óxidos de boro y el fluoruro de hidrógeno. Sin embargo, para necesidades de laboratorio, podemos producir trifluoruro de boro usando eterato de trifluoruro de boro (un líquido disponible comercialmente).
¿Cuál es la diferencia entre el amoníaco y el trifluoruro de boro?
El amoníaco y el trifluoruro de boro son moléculas de 4 átomos que tienen un átomo central unido a otros tres átomos. Sin embargo, a diferencia de la molécula de trifluoruro de boro, la molécula de amoníaco tiene un par solitario de electrones que la hace polar. Por lo tanto, la diferencia clave entre el amoníaco y el trifluoruro de boro es que el amoníaco es una molécula polar, mientras que el trifluoruro de boro es una molécula no polar.
La siguiente infografía enumera la diferencia entre el amoníaco y el trifluoruro de boro en forma tabular para una comparación directa.
Resumen: amoníaco frente a trifluoruro de boro
El amoníaco es un compuesto inorgánico con la fórmula química NH3, mientras que el trifluoruro de boro es un compuesto inorgánico con la fórmula química BF3. La diferencia clave entre el amoníaco y el trifluoruro de boro es que el amoníaco es una molécula polar, mientras que el trifluoruro de boro es una molécula no polar.
Relación:
1. "Síntesis de amoníaco: proceso y reacción". estudio.com
Imagen de cortesía:
1. "Ammonia-2D" por Radio89 - Trabajo propio (CC BY-SA 3.0) a través de Commons Wikimedia
2. "Dimensiones 2D de trifluoruro de boro" por Ben Mills - Trabajo propio (Dominio público) a través de Commons Wikimedia













