Que diferencia principal entre calor de fusión y cristalización es que El calor de fusión se refiere al cambio de energía cuando un estado sólido de una sustancia dada pasa al estado líquido, mientras que el calor de cristalización se refiere al calor absorbido o desprendido cuando un mol de una sustancia dada cristaliza..
Lectura relacionada: Diferencia entre alcohol desnaturalizado y alcohol isopropílico
Diferencia entre alcohol desnaturalizado y alcohol isopropílicoLas reacciones químicas ocurren típicamente a través de la absorción o liberación de energía. La energía se libera o absorbe principalmente en forma de calor. Por lo tanto, el cambio de energía para una reacción dada puede denominarse calor de esa reacción o entalpía de esa reacción.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es el calor de fusión?
3. ¿Qué es el calor de cristalización?
4. Comparación lado a lado: calor de fusión frente a cristalización en forma tabular
5. Resumen
¿Qué es el calor de fusión?
El calor de la fusión entalpía de fusión es el cambio de energía durante la transición de fase de una sustancia del estado sólido al líquido. Por lo general, los cambios de energía ocurren en forma de calor y la reacción debe tener lugar a una presión constante para definir un calor de fusión apropiado. El calor de solidificación es el mismo y opuesto término para el calor de fusión.
Lectura relacionada: Diferencia entre reacción fotoquímica y electroquímica.
Diferencia entre reacción fotoquímica y electroquímica.El calor de fusión se define para la fusión de una sustancia. Este cambio de energía se llama calor latente porque la temperatura permanece constante durante todo el proceso de conversión. Si observa el cambio de energía por mol de sustancia, puede llamar a este proceso calor molar de fusión.

En general, la fase líquida de una sustancia tiene una energía interna alta en comparación con su fase sólida porque su energía cinética es mayor que la energía potencial. Así que tenemos que agregar algo de energía a un sólido para derretirlo. Por el contrario, una sustancia libera energía cuando un líquido se solidifica o se congela. Esto se debe principalmente a que las moléculas en el líquido experimentan interacciones intermoleculares más débiles que las moléculas en la fase sólida.
Lectura relacionada: Diferencia entre prototropía y tautomerismo
Diferencia entre prototropía y tautomerismo¿Qué es el calor de cristalización?
El calor de la cristalización entalpía de cristalización es la energía que cambia cuando una sustancia cristaliza. La cristalización puede ocurrir como un proceso natural o como un proceso artificial. En la fase sólida de una sustancia, las moléculas o átomos están altamente organizados en una estructura cristalina. A esto lo llamamos una estructura cristalina. Un cristal se puede formar de varias maneras, p. B. por precipitación de una solución, congelación, deposición directa de un gas (raramente), etc.

Hay dos pasos principales en la cristalización: la nucleación (una fase cristalina aparece en un líquido sobreenfriado o en un solvente sobresaturado) y el crecimiento de cristales (el aumento en el tamaño de las partículas, que da como resultado un estado cristalino).
¿Cuál es la diferencia entre calor de fusión y cristalización?
Una reacción química ocurre al absorber o liberar energía en forma de calor. El calor de fusión y el calor de cristalización son dos ejemplos de este tipo de reacción. Y la diferencia clave entre el calor de fusión y la cristalización es que el calor de fusión se refiere al cambio de energía cuando un estado sólido de una sustancia dada pasa a un estado líquido, mientras que el calor de cristalización se refiere al calor que se absorbe o se desprende cuando un mol de una sustancia dada cristaliza.
A continuación se muestra una lista tabular resumida de la diferencia entre el calor de fusión y el calor de cristalización.

Resumen: calor de fusión frente a cristalización
Una reacción química ocurre al absorber o liberar energía en forma de calor. El calor de fusión y el calor de cristalización son dos ejemplos de este tipo de reacción. La diferencia clave entre el calor de fusión y la cristalización es que el calor de fusión se refiere al cambio de energía cuando un estado sólido de una sustancia dada pasa al estado líquido, mientras que el calor de cristalización se refiere al calor que se absorbe o se desprende al tomar moles de una sustancia dada cristaliza.
Relación:
1. “Calor de fusión”. Química LibreTexts, Libretexts, 14 de julio de 2020, disponible aquí.
Imagen de cortesía:
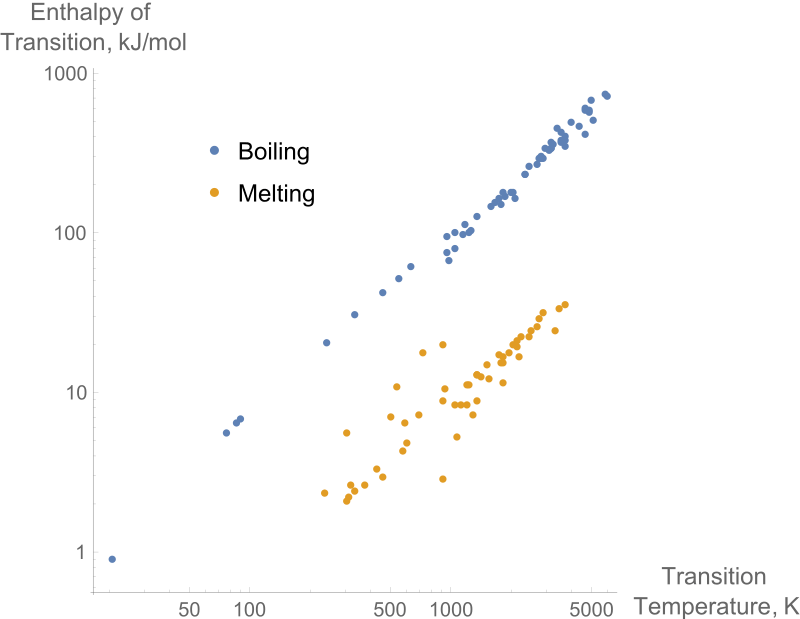
1. "Entalpías de fusión y ebullición de elementos puros en comparación con las temperaturas de transición" Por Mgibby5 (CC BY-SA 3.0) a través de Commons Wikimedia
2. "SnowflakesWilsonBentley" de Wilson Bentley - Lámina XIX de "Studies Among the Snow Crystals..." de Wilson Bentley, "The Snowflake Man". Del resumen anual del 'Informe meteorológico mensual' para 1902 (dominio público) a través de Commons Wikimedia