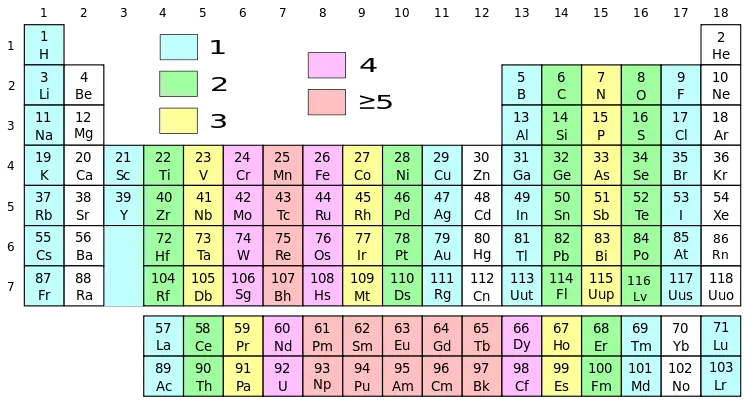
Que diferencia principal entre los elementos del grupo 1 y del grupo 2 es que Todos los elementos del grupo 1 tienen electrones desapareados en su orbital más externo, mientras que los elementos del grupo 2 tienen electrones apareados en su orbital más externo.
Lectura relacionada: Diferencia entre alcohol cetílico y alcohol estearílico
Diferencia entre alcohol cetílico y alcohol estearílicoLos grupos 1 y 2 de la tabla periódica contienen elementos del bloque s. Eso significa; estos elementos tienen sus electrones más externos en el orbital s. Los grupos 1 y 2 difieren según el número de electrones en su orbital más externo. Un orbital solo puede contener dos electrones porque el número cuántico magnético de ese orbital es 0.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué son los elementos del Grupo 1?
3. ¿Qué son los elementos del Grupo 2?
4. Comparación lado a lado - Elementos del Grupo 1 y Grupo 2 en forma tabular
5. Resumen
¿Qué son los elementos del Grupo 1?
Los elementos del grupo 1 son elementos químicos con un electrón desapareado en el orbital s más externo. Es la primera columna del bloque s de la tabla periódica. Contiene hidrógeno y metales alcalinos. Los miembros de este Grupo 1 son los siguientes:
Lectura relacionada: Diferencia entre cromato y dicromato.
Diferencia entre cromato y dicromato.- hidrógeno (H)
- Litio (Li)
- Sodio (Na)
- Potasio (K)
- Rubidio (Rh)
- Cesio (Cs)
- Franconia (viernes)

Figura 01: Tabla periódica con diferentes grupos en diferentes colores.
Aunque el hidrógeno pertenece a este grupo debido a su configuración electrónica, tiene propiedades que difieren de los metales alcalinos. Por ejemplo, el hidrógeno existe como gas, mientras que otros elementos de este grupo son metales. Estos metales son todos brillantes, muy reactivos y muy blandos (podemos cortarlos fácilmente con un simple cuchillo).
Lectura relacionada: Diferencia entre la reacción de Gattermann y Gattermann-Koch
Diferencia entre la reacción de Gattermann y Gattermann-KochEn general, los elementos del Grupo 1 exhiben bajas densidades, bajos puntos de fusión, bajos puntos de ebullición y tienen estructuras cristalinas cúbicas centradas en el cuerpo. Además, tienen diferentes colores de llama, por lo que podemos diferenciarlos fácilmente al exponer una muestra a un mechero Bunsen. Bajando el grupo de metales alcalinos hay algunas variaciones periódicas que se enumeran a continuación.
- El tamaño atómico aumenta
- El punto de fusión y el punto de ebullición disminuyen a medida que disminuye la capacidad de formar enlaces fuertes en el grupo (cuando el átomo se vuelve grande, el enlace formado es débil).
- La densidad aumenta.
- La primera energía de ionización disminuye porque en los átomos grandes el electrón más externo está débilmente ligado y puede eliminarse con facilidad.
- electronegatividad
- La reactividad disminuye.
- Los metales alcalinos tienen afinidades electrónicas más bajas que otros elementos.
¿Qué son los elementos del Grupo 2?
Los elementos del grupo 2 son elementos químicos cuyo par de electrones más externo se encuentra en un orbital s. Por lo tanto, sus electrones de valencia están en forma de ns2. Además, este grupo es la segunda columna del bloque s. Los llamamos metales alcalinotérreos. Los integrantes de este grupo son los siguientes:
- Berilio (Be)
- Magnesio (Mg)
- Calcio (Ca)
- Estroncio (Sr)
- Bario (Ba)
- radio (Ra)

Figura 02: Puntos de fusión de los elementos.
Estos elementos metálicos tienden a estabilizar su configuración electrónica eliminando los dos electrones más externos para obtener una configuración electrónica de gas noble. Por tanto, estos elementos tienden a formar cationes +2. Estos metales son menos reactivos en comparación con los elementos del Grupo 1. Además, en comparación con los elementos del Grupo 1, estos elementos tienen puntos de fusión más altos y sus hidróxidos son comparativamente menos básicos.
¿Cuál es la diferencia entre los elementos del Grupo 1 y del Grupo 2?
Los grupos 1 y 2 se diferencian entre sí según el número de electrones en su orbital más externo. La principal diferencia entre los elementos del Grupo 1 y del Grupo 2 es que todos los elementos del Grupo 1 tienen electrones desapareados en su orbital más externo, mientras que los elementos del Grupo 2 tienen electrones apareados en su orbital más externo.
La siguiente infografía muestra más comparaciones con respecto a la diferencia entre los elementos del Grupo 1 y el Grupo 2.

Resumen: elementos del grupo 1 frente al grupo 2
Los grupos 1 y 2 se diferencian entre sí según el número de electrones en su orbital más externo. La principal diferencia entre los elementos del Grupo 1 y del Grupo 2 es que todos los elementos del Grupo 1 tienen electrones desapareados en su orbital más externo, mientras que los elementos del Grupo 2 tienen electrones apareados en su orbital más externo.
Relación:
1. "Grupo 1: hidrógeno y metales alcalinos". Química LibreTexts, Libretexts, 23 de junio de 2019, disponible aquí.
2. Helmenstine, Anne Marie. "Tabla periódica de grupos de elementos". ThoughtCo, 11 de noviembre de 2019, disponible aquí.
Imagen de cortesía:
1. "Tabla periódica con electrones no apareados" por KES47 - Versión SVG de una imagen JPG creada por Sai2020 el 2009-02-03: Archivo: Tabla periódica con e-.jpg no apareado, (Dominio público) a través de Commons Wikimedia
2. "Punto de fusión de los elementos (K)" Por Albris - Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia