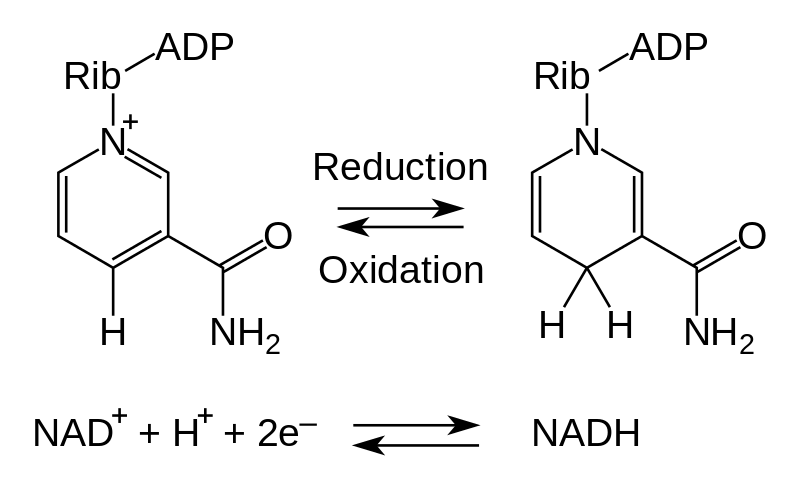
Que diferencia principal entre oxidación y reducción es que La oxidación se refiere a la pérdida de electrones, mientras que la reducción se refiere a la ganancia de electrones.
Lectura relacionada: Diferencia entre gasolina y diesel
Diferencia entre gasolina y dieselLas reacciones químicas entre diferentes compuestos se denominan reacciones redox cuando los estados de oxidación de los reactivos difieren de los de los productos. Redox es la abreviatura de reducción-oxidación, que ocurre en cada reacción química. Mientras que las oxidaciones se refieren a la pérdida de electrones, las reducciones implican la recuperación de electrones. Estas reacciones pueden ser simples o complejas según el proceso y los átomos involucrados.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la oxidación?
3. ¿Qué es la reducción?
4. Comparación lado a lado: oxidación frente a reducción en forma tabular
5. Resumen
¿Qué es la oxidación?
La oxidación se puede describir como un aumento en el número de oxidación. Por lo tanto, la oxidación se puede definir como la pérdida de electrones de un átomo, molécula o ion. Esta pérdida de electrones hace que aumente el estado de oxidación de las especies químicas. Dado que una reacción de oxidación libera electrones, debe haber una especie aceptora de electrones. Por lo tanto, la reacción de oxidación es la mitad de una reacción principal. La oxidación de una especie química se expresa como un cambio en su estado de oxidación. El estado de oxidación es un número con un símbolo positivo (+) o negativo (-) que indica la pérdida o ganancia de electrones por parte de un átomo, molécula o ion en particular.
Lectura relacionada: Diferencia entre amoníaco e hidróxido de amonio.
Diferencia entre amoníaco e hidróxido de amonio.
Figura 01: Un ejemplo de las dos medias reacciones: oxidación y reducción.
En el pasado, el término oxidación se definía con la definición "adición de oxígeno a un compuesto". En ese momento, el oxígeno era el único agente oxidante conocido. Sin embargo, esta definición ya no es precisa ya que hay muchas otras reacciones de oxidación que ocurren en ausencia de oxígeno. Por ejemplo, la reacción entre el magnesio (Mg) y el ácido clorhídrico (HCl) no involucra oxígeno, pero es una reacción redox que involucra la oxidación de Mg a Mg.2+.
Lectura relacionada: Diferencia entre carbono y grafito.
Diferencia entre carbono y grafito.¿Qué es la reducción?
La reducción se puede describir como una disminución en el número de oxidación. Por tanto podemos definir la reducción como la extracción de electrones de un átomo, una molécula o un ion. Esta ganancia de electrones hace que disminuya el estado de oxidación de las especies químicas. Dado que una reacción de reducción recibe electrones, debe haber una especie donadora de electrones. Por lo tanto, la reacción de reducción es la mitad de una reacción principal. La reducción de una especie química se expresa como un cambio en su estado de oxidación.
En el pasado, el término reducción se definía como “la eliminación de oxígeno de un compuesto”. En ese momento, el oxígeno era el único agente oxidante conocido. Sin embargo, esta definición ya no es precisa ya que hay muchas otras reacciones de oxidación que ocurren en ausencia de oxígeno.
¿Cuál es la diferencia entre oxidación y reducción?
La reducción y la oxidación son procesos químicos involucrados en cada reacción química. Estas son dos reacciones opuestas. La diferencia clave entre oxidación y reducción es que la oxidación se refiere a la pérdida de electrones, mientras que la reducción se refiere a la ganancia de electrones. Mientras que la oxidación aumenta el valor del signo positivo (+), la reducción aumenta el valor del signo negativo (-).
Resumen - Oxidación vs. Reducción
La reducción y la oxidación son procesos químicos involucrados en cada reacción química. La diferencia clave entre oxidación y reducción es que la oxidación se refiere a la pérdida de electrones, mientras que la reducción se refiere a la ganancia de electrones.
Relación:
1. Helmenstine, Anne Marie. "Definición de oxidación y ejemplo en química". ThoughtCo, 12 de febrero de 2020, disponible aquí.
2. Helmenstine, Anne Marie. "Definición de reducción en química". ThoughtCo, 11 de febrero de 2020, disponible aquí.
Imagen de cortesía:
1. “Reducción de la oxidación de NAD” Por Fvasconcellos 19:44, 9 de diciembre de 2007 (UTC). w:Imagen:Reducción de oxidación de NAD.png por Tim Vickers. - Versión vectorial de w:Imagen:NAD oxidación reducción.png por Tim Vickers (Dominio público) a través de Commons Wikimedia