Que diferencia principal que se encuentra entre los sólidos moleculares y los sólidos de la red covalente los sólidos moleculares se forman debido a la acción de las fuerzas de van der Waal, mientras que los sólidos de la red covalente se forman debido a la acción de los enlaces químicos covalentes.
Lectura relacionada: Diferencia entre acción capilar y tirón de transpiración.
Diferencia entre acción capilar y tirón de transpiración.Podemos categorizar los compuestos sólidos de diferentes maneras: en función de la estructura, la composición, los enlaces, las propiedades, las aplicaciones, etc. Los sólidos moleculares, los sólidos iónicos, los sólidos metálicos y los sólidos de red covalente son tipos de sólidos tan diferentes.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es un sólido molecular?
3. ¿Qué es un sólido de red covalente?
4. Comparación lado a lado: sólido molecular frente a sólido de red covalente en forma tabular
5. Resumen
¿Qué es un sólido molecular?
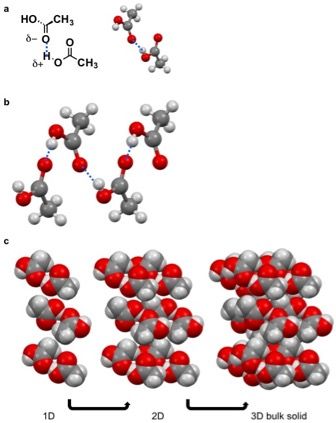
Un sólido molecular es un compuesto sólido que contiene moléculas unidas por fuerzas de van der Waal. No hay enlaces iónicos o covalentes entre estas moléculas. Las fuerzas entre estas moléculas son fuerzas cohesivas de atracción. Hay diferentes tipos de fuerzas de van der Waal que pueden causar la formación de un sólido molecular, es decir, interacciones dipolo-dipolo, interacciones pi-pi, enlaces de hidrógeno, fuerzas de London, etc.
Lectura relacionada: Diferencia entre fenilamina y aminobenceno.
Diferencia entre fenilamina y aminobenceno.
Figura 01: Formación de sólidos moleculares por enlaces de hidrógeno.
Sin embargo, estas fuerzas de van der Waal son más débiles en comparación con los enlaces químicos iónicos y covalentes. Por lo tanto, los sólidos moleculares suelen tener puntos de fusión y ebullición relativamente bajos. Además, estos sólidos tienden a disolverse en disolventes orgánicos. Estos sólidos moleculares son de baja densidad y también no conductores; por lo tanto, son aislantes eléctricos blandos.
Lectura relacionada: Diferencia entre NF3 y NH3
Diferencia entre NF3 y NH3
Figura 02: el dióxido de carbono sólido y la cafeína sólida son sólidos moleculares
Además, al considerar los diferentes alótropos de un elemento químico, todos los alótropos a veces existen como sólidos moleculares, pero la mayoría de los alótropos son sólidos moleculares, mientras que otros alótropos del mismo elemento químico no son sólidos moleculares. Por ejemplo, existen diferentes formas alotrópicas de fósforo; Los llamamos fósforo rojo, blanco y negro. Entre ellos, el fósforo blanco es un sólido molecular, pero el fósforo rojo existe como estructuras de cadena.
Además, los sólidos moleculares son dúctiles o quebradizos, según la naturaleza de las caras cristalinas del sólido. Tanto estas formas dúctiles como las frágiles también pueden deformarse elásticamente.
¿Qué es una red covalente sólida?
Los sólidos de red covalente son compuestos sólidos que contienen átomos unidos por enlaces químicos covalentes. Estos sólidos tienen varios átomos repetidos unidos entre sí por enlaces covalentes. El enlace químico puede causar la formación de una red de átomos, dando como resultado la formación de una red sólida. Por lo tanto, podemos considerar una red covalente sólida como una especie de macromolécula.
Además, estos sólidos pueden presentarse de dos formas; como sólidos cristalinos o sólidos amorfos. Un ejemplo adecuado de una red sólida es el diamante con átomos de carbono unidos covalentemente que forman una estructura 3D fuerte. Por lo general, los sólidos de la red covalente tienen puntos de fusión y de ebullición relativamente altos. En general, estos sólidos son insolubles en cualquier tipo de disolvente porque es muy difícil romper los enlaces entre los átomos. Además, estos sólidos son muy duros y tienen baja conductividad eléctrica en su fase líquida. La conductividad eléctrica de la fase sólida puede variar según la composición.
¿Cuál es la diferencia entre sólido molecular y sólido de red covalente?
Los sólidos moleculares y los sólidos de red covalente son dos tipos de compuestos sólidos. La diferencia clave entre el sólido molecular y el sólido de la red covalente es que el sólido molecular se forma debido a la acción de las fuerzas de van der Waal, mientras que el sólido de la red covalente se forma debido a la acción de los enlaces químicos covalentes. Al considerar sus propiedades, los sólidos moleculares son materiales relativamente blandos, mientras que los sólidos con redes covalentes son muy duros.
Además, los sólidos moleculares tienen puntos de fusión relativamente bajos, mientras que los sólidos con redes covalentes tienen puntos de fusión muy altos. Además, los sólidos moleculares son aislantes eléctricos, mientras que los sólidos con una red covalente tienen baja conductividad eléctrica en estado líquido, y la conductividad eléctrica en fase sólida puede variar con la composición. El hielo de agua es un buen ejemplo de un sólido molecular, mientras que el diamante es el mejor ejemplo de un sólido de red covalente.
La siguiente infografía resume la diferencia entre sólido molecular y sólido de red covalente.

Resumen: sólido molecular frente a sólido de red covalente
Los sólidos moleculares y los sólidos de red covalente son dos tipos de compuestos sólidos. La diferencia clave entre el sólido molecular y el sólido de la red covalente es que el sólido molecular se forma debido a la acción de las fuerzas de van der Waal, mientras que el sólido de la red covalente se forma debido a la acción de los enlaces químicos covalentes.
Relación:
1. Helmenstine, Annemarie. "Sólidos moleculares: definición y ejemplos." ThoughtCo, 3 de diciembre de 2018, disponible aquí.
2. Helmenstine, Anne Marie. "Definición sólida de red en química". ThoughtCo, 8 de julio de 2019, disponible aquí.
Imagen de cortesía:
1. "Enlace de hidrógeno del ácido acético" por Cryst eng 340 - Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia
2. "Dióxido de carbono y cafeína" Por Cryst eng 340 - Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia