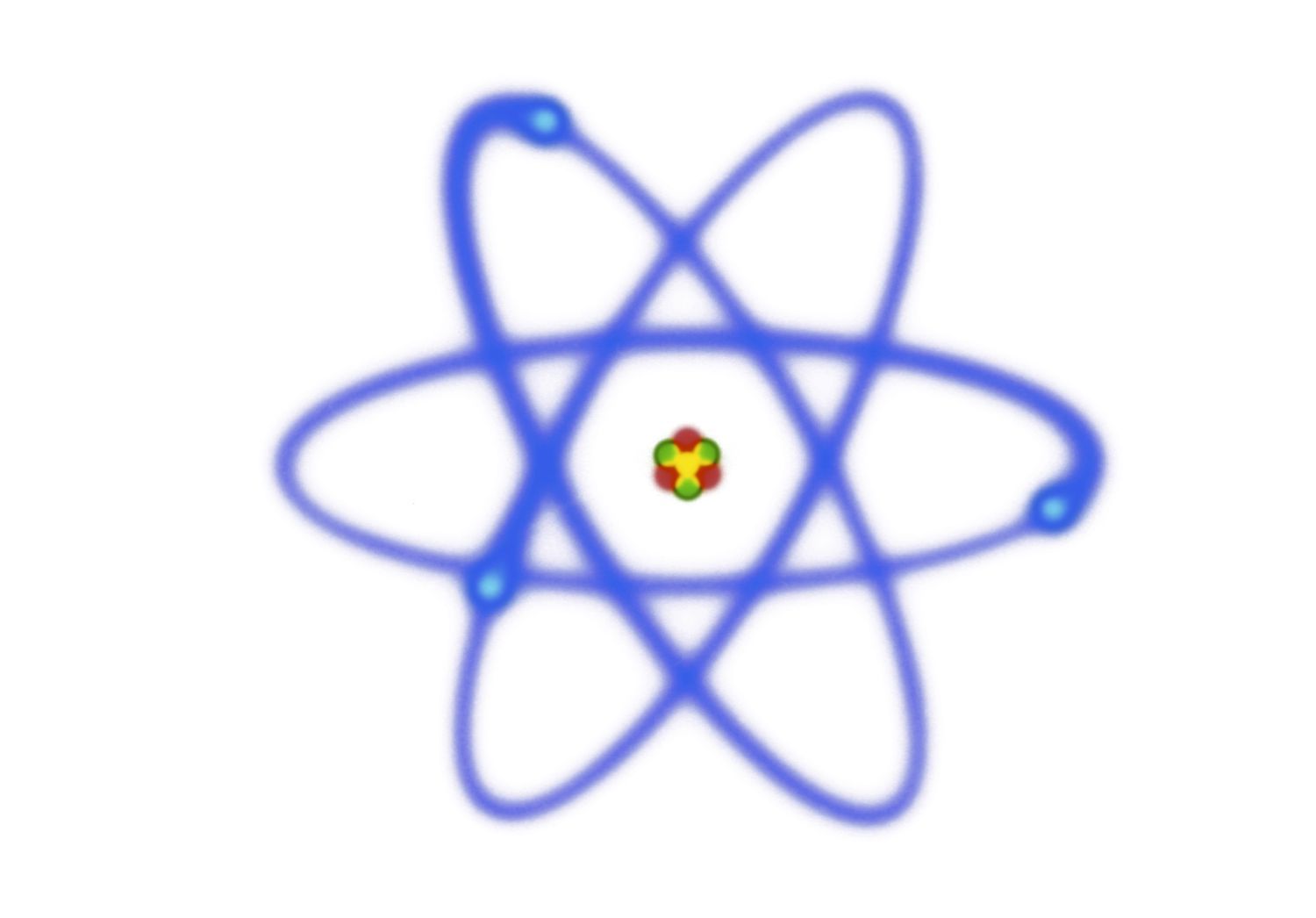
Los átomos son unidades fundamentales de materia que no pueden descomponerse por ningún medio químico. Estos componentes constitutivos de la materia son esenciales para entender la composición del universo a nivel microscópico.
5 ejemplos de átomos
Para ilustrar mejor, aquí presentamos 5 ejemplos de átomos que son comúnmente reconocidos:
- El átomo de oxígeno (O), esencial para la respiración y la combustión.
- El átomo de carbono (C), conocido como la base de la química orgánica.
- El átomo de oro (Au), un metal precioso usado en joyería y electrónica.
- El átomo de helio (He), un gas noble utilizado en globos y refrigerantes.
- El átomo de silicio (Si), un elemento clave en la fabricación de semiconductores.
Continuando con este enfoque didáctico, también podemos destacar otros 5 ejemplos de átomos que contribuyen a la diversidad de la materia:
Lectura relacionada: Definición de Plasma en Química y Física
Definición de Plasma en Química y Física- El átomo de hidrógeno (H), el elemento más simple y abundante en el universo.
- El átomo de nitrógeno (N), componente fundamental de la atmósfera terrestre.
- El átomo de hierro (Fe), crucial para la formación de hemoglobina en la sangre.
- El átomo de cloro (Cl), utilizado en desinfectantes y en la producción de plásticos.
- El átomo de uranio (U), conocido por su aplicación en energía nuclear.
¿Qué Hace que Algo sea un Átomo?
Los bloques de construcción de los átomos son protones cargados positivamente, neutrones neutros y electrones cargados negativamente. Los protones y neutrones son similares en masa, mientras que los electrones son mucho más pequeños y ligeros. Muchos átomos consisten en un núcleo cargado positivamente compuesto de protones y neutrones rodeados por una nube de electrones cargados negativamente. En su nivel más básico, un átomo es cualquier partícula de materia que contiene al menos un protón, siendo los electrones y neutrones componentes comunes pero no esenciales.
Los átomos pueden ser neutros o estar cargados eléctricamente. Un átomo que lleva una carga positiva o negativa se llama ion atómico, lo cual altera sus propiedades y comportamiento químico.
Lectura relacionada: Por Qué las Baterías Se Descargan Más Rápidamente en Climas Fríos
Por Qué las Baterías Se Descargan Más Rápidamente en Climas Fríos
Los átomos de un solo elemento que tienen diferentes números de neutrones entre sí se denominan isótopos, lo que puede dar lugar a variaciones en sus propiedades físicas y químicas.
Una sola partícula de cualquier elemento enumerado en la tabla periódica es un átomo. El número de protones presentes determina el orden de un átomo en la tabla periódica, junto con su nombre, símbolo e identidad química, definiendo así sus características únicas.
Aquí hay algunos ejemplos de átomos que son fundamentales para diferentes aplicaciones y procesos en la ciencia y la industria:
Lectura relacionada: Serie de Actividad de Metales: Predicción de la Reactividad
Serie de Actividad de Metales: Predicción de la Reactividad- Neón (Ne)
- Hidrógeno (H)
- Argón (Ar)
- Hierro (Fe)
- Calcio (Ca)
- Deuterio, un isótopo de hidrógeno que tiene un protón y un neutrón
- Plutonio (Pu)
- F-, un anión flúor
- Protio, un isótopo del hidrógeno
Átomos Versus Moléculas
Cuando los átomos se unen, se convierten en moléculas. Este proceso de combinación da lugar a sustancias con propiedades completamente diferentes a las de los átomos individuales. Por ejemplo, el símbolo químico de una molécula de agua, H2O, indica que está formada por dos átomos de hidrógeno y uno de oxígeno, creando una sustancia con características únicas.
Por ejemplo, O representa un solo átomo de oxígeno, mientras que O2 es una molécula de oxígeno gaseoso compuesta por dos átomos de oxígeno, y O3 es una molécula de ozono formada por tres átomos de oxígeno.
El símbolo del agua, H2O, demuestra cómo los átomos se combinan para formar moléculas con propiedades distintas a las de sus átomos constituyentes.
Así, todas las moléculas contienen átomos, pero los átomos individuales son los bloques de construcción básicos que se unen para formar estas estructuras más complejas.
¿Qué No Es un Átomo?
Para entender lo que constituye un átomo, también es útil identificar lo que definitivamente no lo es.
- Los átomos son unidades de materia, así que cualquier cosa que no consista en materia, como la luz, el calor, los sueños o el sonido, no puede considerarse un átomo.
- Las partículas subatómicas individuales, como los electrones o neutrones aislados, no constituyen átomos por sí mismos.
Aunque técnicamente los iones, moléculas y compuestos están compuestos por átomos, es más común referirse a un átomo como una sola partícula de un elemento, usualmente neutra y sin carga neta.
Fuentes
- Einstein, Albert (1905). "Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendieren Teilchen" (en alemán). Annalen der Physik (en alemán). 322 (8): 549–560.
- Heilbron, John L. (2003). Ernest Rutherford y la Explosión de Átomos. Oxford University Press. ISBN 0-19-512378-6.
- Holbrow, Charles H.; Lloyd, James N.; Amato, Joseph C.; Gálvez, Enrique; Parks, M. Elizabeth (2010). Física Introductoria Moderna. Springer Science & amp; Medios de negocios. ISBN 9780387790794.
- Pullman, Bernard (1998). El Átomo en la Historia del Pensamiento Humano. Oxford, Inglaterra: Oxford University Press. pp.31-33. ISBN 978-0-19-515040-7.
- van Melsen, Andrew G. (2004) [1952]. De Átomo a Átomo: La historia del Concepto Átomo. Traducido por Henry J. Koren. Publicaciones de Dover. ISBN 0-486-49584-1.