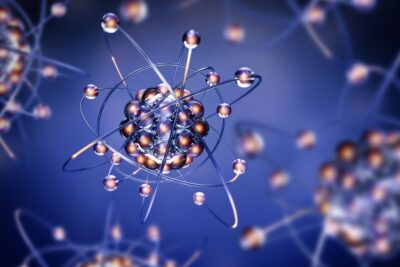
El átomo modelo de Bohr tiene un núcleo pequeño con carga positiva orbitado por electrones con carga negativa. Esta descripción es una parte fundamental del átomo de Bohr y es conocida por su sencillez y su capacidad para explicar fenómenos como las líneas espectrales del hidrógeno. Aquí hay una mirada más cercana al Modelo de Bohr, que a veces se llama Modelo de Rutherford-Bohr, especialmente en referencia a las características del átomo Rutherford y sus extensiones en el trabajo de Bohr.
Descripción general del Modelo de Bohr
Niels Bohr propuso el Modelo de Bohr del Átomo en 1915. Debido a que el átomo Modelo de Bohr es una modificación del Modelo de Rutherford anterior, algunas personas llaman al Modelo de Bohr el Modelo de Rutherford-Bohr. Entre las características fundamentales del átomo Rutherford se incluye la idea de un núcleo central, que Bohr utilizó como punto de partida para su modelo atómico. El modelo moderno del átomo se basa en la mecánica cuántica. El átomo Bohr contiene algunos errores, pero es importante porque describe la mayoría de las características aceptadas de la teoría atómica sin todas las matemáticas de alto nivel de la versión moderna. A diferencia de los modelos anteriores, el Modelo de Bohr explica la fórmula de Rydberg para las líneas de emisión espectral del hidrógeno atómico.
Lectura relacionada: Definición de Cambio Químico en Química
Definición de Cambio Químico en QuímicaEl átomo de Bohr es un modelo planetario en el que los electrones cargados negativamente orbitan un núcleo pequeño y cargado positivamente similar a los planetas que orbitan el sol (excepto que las órbitas no son planas). La fuerza gravitacional del sistema solar es matemáticamente similar a la fuerza de Culombio (eléctrica) entre el núcleo cargado positivamente y los electrones cargados negativamente.
Puntos principales del Modelo de Bohr
- Los electrones orbitan el núcleo en órbitas que tienen un tamaño y energía establecidos, lo cual es una de las premisas centrales del átomo modelo de Bohr.
- La energía de la órbita está relacionada con su tamaño. La energía más baja se encuentra en la órbita más pequeña, lo que refleja un aspecto del átomo Bohr.
- La radiación se absorbe o emite cuando un electrón se mueve de una órbita a otra, lo cual es una característica indispensable de los átomos modelo de Bohr.
Lectura relacionada:
 Chemistry Vocabulary - Definitions of Chemistry Terms
Chemistry Vocabulary - Definitions of Chemistry TermsModelo de Bohr del Hidrógeno
El ejemplo más simple del átomo de Bohr es para el átomo de hidrógeno (Z = 1) o para un ion similar al hidrógeno (Z > 1), en el que un electrón cargado negativamente orbita un pequeño núcleo cargado positivamente. La energía electromagnética será absorbida o emitida si un electrón se mueve de una órbita a otra en este átomo Bohr. Solo se permiten ciertas órbitas de electrones. El radio de las órbitas posibles aumenta a medida que n2, donde n es el número cuántico principal. La transición 3 → 2 produce la primera línea de la serie Balmer. Para hidrógeno (Z = 1), esto produce un fotón que tiene una longitud de onda de 656 nm (luz roja).
Modelo de Bohr para Átomos Más Pesados
Los átomos más pesados contienen más protones en el núcleo que el átomo de hidrógeno. Se necesitaban más electrones para cancelar la carga positiva de todos estos protones. Bohr creía que cada órbita de electrones solo podía contener un número determinado de electrones. Una vez que el nivel estaba lleno, los electrones adicionales se elevaban al siguiente nivel. Por lo tanto, el modelo de Bohr para átomos más pesados describió capas de electrones. El modelo explicaba algunas de las propiedades atómicas de los átomos más pesados, que nunca antes se habían reproducido. Por ejemplo, el modelo de la capa explicaba por qué los átomos se hacían más pequeños al moverse a través de un período (fila) de la tabla periódica, a pesar de que tenían más protones y electrones. También explicó por qué los gases nobles eran inertes y por qué los átomos en el lado izquierdo de la tabla periódica atraen electrones, mientras que los del lado derecho los pierden. Sin embargo, el modelo asumió que los electrones en las capas no interactuaban entre sí y no podía explicar por qué los electrones parecían apilarse de manera irregular.
Lectura relacionada: Propiedades Químicas y Físicas del Cobre
Propiedades Químicas y Físicas del Cobre
Problemas Con el Modelo de Bohr
- Viola el Principio de Incertidumbre de Heisenberg porque considera que los electrones tienen un radio y una órbita conocidos, un desafío en la descripción del átomo Bohr.
- El modelo de Bohr proporciona un valor incorrecto para el momento angular orbital del estado fundamental.
- Hace malas predicciones con respecto a los espectros de átomos más grandes, lo que aleja del átomo modelo de Bohr.
- No predice las intensidades relativas de las líneas espectrales.
- El modelo de Bohr no explica la estructura fina y la estructura hiperfina en líneas espectrales.
- No explica el Efecto Zeeman.
Refinamientos y Mejoras del Modelo de Bohr
El refinamiento más destacado del modelo de Bohr fue el modelo de Sommerfeld, que a veces se denomina modelo de Bohr-Sommerfeld. En este modelo, los electrones viajan en órbitas elípticas alrededor del núcleo en lugar de en órbitas circulares. El modelo de Sommerfeld fue mejor para explicar los efectos espectrales atómicos, como el efecto Stark en la división de líneas espectrales. Sin embargo, el modelo no podía acomodar el número cuántico magnético.
En última instancia, el modelo de Bohr y los modelos basados en él fueron reemplazados por el modelo de Wolfgang Pauli basado en la mecánica cuántica en 1925. Ese modelo fue mejorado para producir el modelo moderno, introducido por Erwin Schrodinger en 1926. Hoy en día, el comportamiento del átomo de hidrógeno se explica utilizando la mecánica de ondas para describir los orbitales atómicos.
Fuentes
- Lakhtakia, Akhlesh; Salpeter, Edwin E. (1996). "Modelos y Modeladores de Hidrógeno". Sociedad Española de Física. 65 (9): 933. Código de Bib: 1997AmJPh..65..933L. doi:10.1119/1.18691
- Linus Carl Pauling (1970). "Capítulo 5-1". Química General (3ª ed.). San Francisco: W. H. Freeman & Co. ISBN 0-486-65622-5.
- Niels Bohr (1913). "Sobre la Constitución de Átomos y Moléculas, Parte I" (PDF). Revista Filosófica. 26 (151): 1–24. doi:10.1080/14786441308634955
- Niels Bohr (1914). "Los espectros de helio e hidrógeno". Naturaleza. 92 (2295): 231–232. doi:10.1038/092231d0