Que diferencia principal entre el centro alostérico y el centro activo es que un sitio alostérico es una región de una enzima que permite que las moléculas activadoras o inhibidoras se unan a la enzima y activen o inhiban la actividad enzimática, mientras que un sitio activo es una región de una enzima a la que se unen las moléculas de sustrato y la reacción resultante será catalizar la producción de ciertos productos.
Las enzimas son proteínas que apoyan las reacciones bioquímicas en el cuerpo humano. Uno de los trabajos más importantes de las enzimas es la digestión. Las enzimas también ayudan con la respiración, el desarrollo muscular, la función nerviosa y la eliminación de toxinas en el cuerpo. Las enzimas tienen diferentes áreas en la estructura a las que las moléculas pueden unirse y catalizar reacciones. Los sitios alostéricos y los sitios activos son dos áreas distintas en la estructura de la enzima que facilitan la unión de moléculas y las reacciones químicas posteriores.
Lectura relacionada: ¿Cuál es la diferencia entre Luminol y Bluestar?
¿Cuál es la diferencia entre Luminol y Bluestar?CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es un sitio alostérico?
3. ¿Qué es un sitio activo?
4. Similitudes: sitio alostérico y sitio activo
5. Sitio alostérico versus sitio activo en forma tabular
6. Resumen: sitio alostérico frente a sitio activo
¿Qué es un sitio alostérico?
El sitio alostérico es una región de una enzima que permite que las moléculas activadoras o inhibidoras se unan a la enzima, activando o inhibiendo la actividad enzimática. Las enzimas funcionan a diferentes temperaturas según el entorno. Además del sustrato principal, varios factores, incluidos el calor, el frío, el pH, la ubicación en el cuerpo y otras sustancias, influyen en la actividad enzimática. Hay algunas sustancias que se unen a la enzima en un sitio diferente al sitio activo normal. Estos sitios donde se pueden unir otras sustancias se denominan sitios alostéricos. Los sitios alostéricos permiten que otras sustancias activen, inhiban o apaguen la actividad enzimática. Esto sucede cuando otras sustancias se unen al sitio alostérico y cambian la confirmación o la forma de la enzima.
 Lectura relacionada:
Lectura relacionada: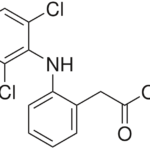 ¿Cuál es la diferencia entre Dicyclomine y Diclofenac?
¿Cuál es la diferencia entre Dicyclomine y Diclofenac?Figura 01: sitio alostérico
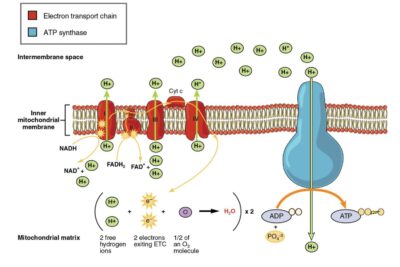
Un ejemplo de un activador alostérico es la unión de oxígeno a la hemoglobina. La unión alostérica de oxígeno a la hemoglobina cambia la confirmación de la hemoglobina y aumenta su afinidad por más oxígeno. Este proceso asegura que la hemoglobina transporte la máxima cantidad de oxígeno desde áreas ricas en oxígeno como los pulmones. Otro ejemplo de un inhibidor alostérico es un ATP en la respiración celular. Una enzima importante involucrada en la glucólisis es la fosfofructoquinasa. Esta enzima convierte el ADP en ATP. Cuando hay demasiado ATP en la célula, el ATP actúa como un inhibidor alostérico, uniéndose al sitio alostérico de la fosfofructocinasa para ralentizar la conversión de ADP en ATP.
¿Qué es un sitio activo?
El sitio activo es la región de una enzima donde las moléculas de sustrato se unen y reaccionan para producir productos. El sitio activo se divide además en dos sitios distintos: sitio de unión y sitio catalítico. En el sitio de unión, los residuos de aminoácidos del sitio activo forman enlaces temporales con el sustrato. Por otro lado, en el sitio catalítico, los residuos de aminoácidos del sitio activo catalizan una reacción de este sustrato.
Lectura relacionada: ¿Cuál es la diferencia entre beta-alanina y L-alanina?
¿Cuál es la diferencia entre beta-alanina y L-alanina?
Figura 02: sitio activo
El sitio activo de una enzima generalmente tiene de tres a cuatro aminoácidos, mientras que se requieren otros aminoácidos en la enzima para mantener la estructura terciaria de la enzima. Un sitio activo de una enzima puede catalizar una reacción repetidamente porque los residuos no cambian al final de la reacción. Este proceso generalmente se logra al disminuir la energía de activación de la reacción. Por lo tanto, más sustratos tienen suficiente energía para sufrir una reacción química.
¿Cuáles son las similitudes entre el sitio alostérico y el sitio activo?
- El sitio alostérico y el sitio activo son dos áreas distintas en la estructura de la enzima que facilitan la unión de moléculas y las reacciones químicas posteriores.
- Ambos sitios están formados por aminoácidos.
- Estas páginas tienen una forma única.
- Ambos sitios son muy importantes para la actividad enzimática y la reacción catalizada por enzimas.
¿Cuál es la diferencia entre el sitio alostérico y el sitio activo?
El sitio alostérico es una región de una enzima que permite que las moléculas activadoras o inhibidoras se unan a la enzima para activar o inhibir la actividad enzimática, mientras que el sitio activo es una región de una enzima a la que se unen las moléculas de sustrato y catalizan la reacción, lo que conduce a la elaboración de productos especiales. Entonces, esta es la diferencia clave entre el sitio alostérico y el sitio activo. Además, los sitios alostéricos solo están presentes en las enzimas alostéricas, mientras que los sitios activos están presentes en todas las enzimas.
La siguiente infografía muestra las diferencias entre el sitio alostérico y el sitio activo en forma tabular para una comparación directa..
Resumen: sitio alostérico frente a sitio activo
El centro alostérico y el centro activo son dos regiones diferentes en la estructura de la enzima. El sitio alostérico es una región de una enzima que permite que las moléculas activadoras o inhibidoras se unan a la enzima, activando o inhibiendo la actividad enzimática, mientras que el sitio activo es una región de una enzima a la que se unen las moléculas de sustrato y catalizan la reacción, lo que lleva a la elaboración de determinados productos. Entonces, esta es la diferencia clave entre el sitio alostérico y el sitio activo.
Relación:
1. "Sitio activo". Una visión general | Temas de ScienceDirect.
2. “¿Qué es un sitio alostérico de la enzima? – Definición y Biología.” Study.com.
Imagen de cortesía:
1. "Figura 06 05 05" por CNX OpenStax - (CC BY 4.0) a través de Commons Wikimedia
2. "Sitio activo SI" por Areid3 - Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia