Que diferencia principal entre inhibición no competitiva y alostérica es que bajo inhibición no competitiva la velocidad máxima de la reacción catalizada (Vmax) disminuye y la concentración de sustrato (Km) permanece sin cambios, mientras que bajo inhibición alostérica Vmax permanece sin cambios y Km aumenta.
Las enzimas son esenciales para la mayoría de las reacciones en los organismos. Normalmente, una enzima cataliza una reacción al reducir la energía de activación requerida para la reacción. Sin embargo, las enzimas deben regularse cuidadosamente para evitar que las concentraciones del producto final aumenten a niveles no deseados. Se controla mediante la inhibición enzimática. Un inhibidor enzimático es una molécula que interfiere con la vía normal entre una enzima y un sustrato.
Lectura relacionada: ¿Cuál es la diferencia entre la esporopolenina y la cutícula?
¿Cuál es la diferencia entre la esporopolenina y la cutícula?Un sitio activo es la región de una enzima donde los sustratos se unen y experimentan una reacción química. En un sitio alostérico, las moléculas pueden activar o inhibir la actividad enzimática. La cinética enzimática juega un papel importante en la inhibición enzimática. La velocidad de reacción máxima característica de una enzima dada a una concentración dada se conoce como velocidad máxima o Vmax. La concentración de sustrato que da la velocidad que es la mitad de Vmax es Km.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la inhibición no competitiva?
3. ¿Qué es la inhibición alostérica?
4. Similitudes - Inhibición no competitiva y alostérica
5. Inhibición no competitiva vs. alostérica en forma tabular
6. Resumen: inhibición no competitiva frente a alostérica
¿Qué es la inhibición no competitiva?
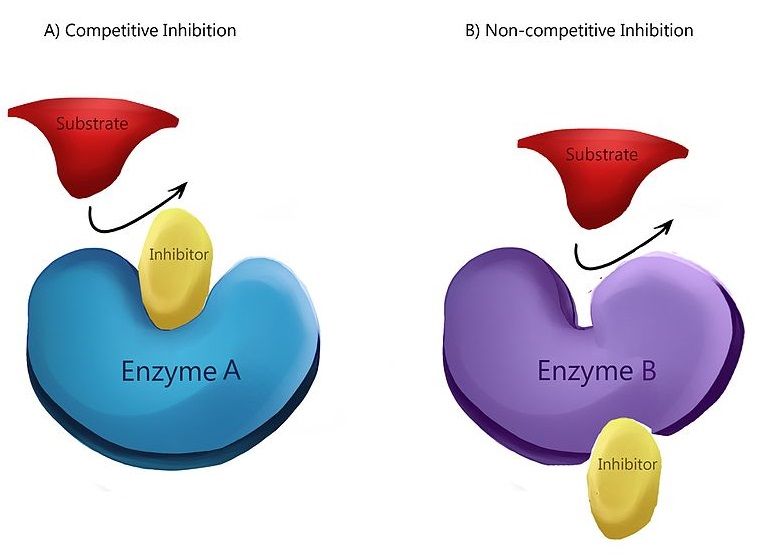
La inhibición no competitiva es un tipo de inhibición enzimática en la que el inhibidor disminuye la actividad enzimática y se une a la enzima igualmente bien esté o no unido al sustrato. En otras palabras, en la inhibición no competitiva, tanto el inhibidor como el sustrato se unen a la enzima en algún punto. Cuando tanto el sustrato como el inhibidor se unen a la enzima, se forma un complejo enzima-sustrato-inhibidor. Una vez que se forma este complejo, no puede producir un producto. Solo se puede volver a convertir en el complejo enzima-sustrato o en el complejo enzima-inhibidor.
Lectura relacionada: ¿Cuál es la diferencia entre Schizophyta y Cyanophyta?
¿Cuál es la diferencia entre Schizophyta y Cyanophyta?
Figura 01: Inhibición no competitiva
En la inhibición no competitiva, el inhibidor tiene igual afinidad por la enzima y el complejo enzima-sustrato. El mecanismo más común de un inhibidor no competitivo es la unión reversible del inhibidor a un sitio alostérico. Pero el inhibidor también tiene la capacidad de unirse directamente al sitio activo. Un ejemplo de un inhibidor no competitivo es la conversión de piruvato quinasa en piruvato. La conversión de fosfoenolpiruvato a piruvato es catalizada por la piruvato quinasa. Un aminoácido llamado alanina, sintetizado a partir del piruvato, inhibe la enzima piruvato quinasa durante la glucólisis. La alanina actúa como un inhibidor no competitivo.
Lectura relacionada: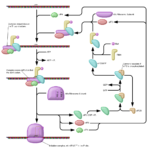 ¿Cuál es la diferencia entre la iniciación de la traducción procariota y eucariota?
¿Cuál es la diferencia entre la iniciación de la traducción procariota y eucariota?¿Qué es la inhibición alostérica?
La inhibición alostérica es un tipo de inhibición enzimática en la que el inhibidor ralentiza la actividad enzimática al desactivar la enzima y unirse a la enzima en el sitio alostérico. El inhibidor no compite directamente con el sustrato en el sitio activo. Pero indirectamente cambia la composición de la enzima. Una vez que se cambia la forma, la enzima se vuelve inactiva. Como resultado, ya no puede unirse al sustrato correspondiente. Esto a su vez ralentiza la formación de productos finales.

Figura 02: inhibición alostérica
La inhibición alostérica previene la formación de productos innecesarios y reduce el desperdicio de energía. Un ejemplo de inhibición alostérica es la conversión de ADP a ATP en la glucólisis. Aquí, cuando hay un exceso de ATP en el sistema, el ATP sirve como inhibidor alostérico. Se une a la fosfofructoquinasa, una de las enzimas implicadas en la glucólisis. Esto ralentiza la conversión de ADP. De esta manera, ATP evita la producción interna innecesaria. Por lo tanto, no se requiere una producción en exceso de ATP cuando hay suficientes cantidades presentes.
¿Cuáles son las similitudes entre la inhibición no competitiva y la alostérica?
- Ambos tipos de inhibición enzimática ralentizan la actividad enzimática.
- Los inhibidores en ambas inhibiciones enzimáticas no compiten con el sustrato en el sitio activo.
- Los inhibidores modifican indirectamente la composición de la enzima.
- Ambos inhibidores cambian la forma de la enzima.
¿Cuál es la diferencia entre la inhibición no competitiva y la alostérica?
Con la inhibición no competitiva, la Vmax de la respuesta disminuye mientras que la Km permanece sin cambios. Por el contrario, con la inhibición alostérica, Vmax permanece sin cambios y Km aumenta. Por lo tanto, esta es la diferencia clave entre la inhibición no competitiva y la alostérica. La inhibición alostérica se centra más en el uso de sustancias químicas que alteran la actividad enzimática al unirse a un sitio alostérico, mientras que los inhibidores no competitivos siempre detienen la enzima en funcionamiento al unirse directamente a un sitio alternativo.
La siguiente infografía tabula las diferencias entre la inhibición no competitiva y la alostérica para una comparación directa.
Resumen: inhibición no competitiva frente a alostérica
La inhibición no competitiva es la inhibición enzimática en la que el inhibidor reduce la actividad enzimática y se une a la enzima igualmente bien tanto si se une al sustrato como si no. La inhibición alostérica es un tipo de inhibición enzimática en la que el inhibidor ralentiza la actividad enzimática al desactivar y unirse a la enzima en el sitio alostérico. La diferencia clave entre la inhibición no competitiva y la alostérica es que la velocidad máxima de la reacción catalizada (Vmax) se reduce y la concentración de sustrato (Km) permanece sin cambios en la inhibición no competitiva, mientras que la Vmax permanece sin cambios y la Km aumenta en la inhibición alostérica.
Relación:
1. “Regulación Alostérica: Protocolo.” Júpiter.
2. "Enzimas". Microbiología sin límites.
Imagen de cortesía:
1. "Inhibición de enzimas competitiva y no competitiva" por California16 - Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia
2. “Inhibición alostérica” por [[:en:User:{{{1}}}|{{{1}}}]]en la Wikipedia en inglés (CC BY-SA 3.0) a través de Commons Wikimedia