1. Un gas ideal está en el volumen V a la temperatura T. Si el volumen se duplica a presión constante, la temperatura será:
2. Un gas ideal se sella en un recipiente a volumen constante. Si la temperatura T se aumenta a 4T, la presión será:
Lectura relacionada: Prueba de Cambios Químicos, Físicos y Nucleares
Prueba de Cambios Químicos, Físicos y Nucleares3. Una muestra de un gas ideal se mantiene a temperatura constante. Si la presión se reduce a 1/2 P, el volumen será:
4. Un cilindro tiene 2 moles de gas ideal a un volumen y presión constantes. Agregar 2 moles más de gas hace que la temperatura
5. La temperatura de un gas ideal se incrementa de 300K a 1200K. La energía cinética:
Lectura relacionada: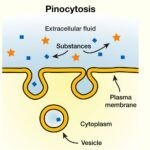 Definición y Ejemplos de Pinocitosis
Definición y Ejemplos de Pinocitosis6. P, V, M, T y R son presión, volumen, masa molar, temperatura y constante de gas, entonces la densidad de un gas ideal es:
7. La temperatura de un gas ideal se incrementa de 300K a 600K. La velocidad molecular promedio de las moléculas de gas
8. Un recipiente sellado tiene 0,10 moles de gas nitrógeno y 0,20 moles de gas oxígeno a temperatura constante. ¿Qué es verdad?
Lectura relacionada: Rudolf Virchow: Padre de la Patología Moderna
Rudolf Virchow: Padre de la Patología Moderna9. Una mezcla de CO2, O2 y He se mantiene a temperatura constante. ¿Qué molécula tiene la velocidad molecular promedio más alta?
10. ¿Cuál de las siguientes condiciones causaría que las leyes de los gases ideales fallen?
Cuestionario sobre la Ley de los Gases Ideales
Tienes: % Correcto. No es una Puntuación Ideal en el Cuestionario de Gases Ideales

Paul Taylor / Getty Images
Buen intento! Llegaste al final de la prueba, pero parece que podrías practicar más con la ley de los gases ideales antes de dominarla. Primero, revise la ecuación para la ley de los gases ideales y luego vea cómo se aplica en un problema de práctica.
¿Listo para otro examen de química? Vea si conoce el pH de los productos químicos domésticos comunes.
Comparte Tus Resultados
Cuestionario sobre la Ley de los Gases Ideales
Tienes: % Correcto. Idealista de la Ley de los Gases Ideales

Luxx Images / Getty Images
¡Buen trabajo! Está familiarizado con la ley de los gases ideales y cómo el cambio de una variable afecta a las demás en la ecuación. Si te sientes un poco inestable, revisa la ley de los gases ideales y un problema de práctica.
¿Estás listo para otro examen de química? Vea si puede reconocer o no tipos comunes de cristalería de laboratorio.
Comparte Tus Resultados