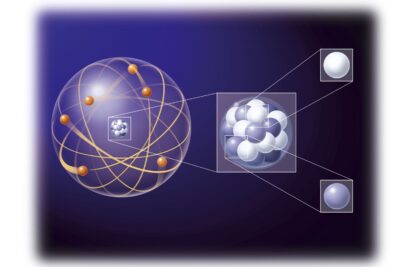
Desintegración radiactiva a proceso espontáneo a través del cual un núcleo atómico inestable se rompe en fragmentos más pequeños y estables. Alguna vez te has preguntado por qué algunos núcleos se descomponen y otros no?
Es básicamente una cuestión de termodinámica. Cada átomo busca ser lo más estable posible. En el caso de la desintegración radiactiva, la inestabilidad ocurre cuando hay un desequilibrio en el número de protones y neutrones en el núcleo atómico. Básicamente, hay demasiada energía dentro del núcleo para mantener todos los nucleones juntos. El estado de los electrones de un átomo no importa para la descomposición, aunque ellos también tienen su propia forma de encontrar estabilidad. Si el núcleo de un átomo es inestable, eventualmente se romperá para perder al menos algunas de las partículas que lo hacen inestable. El núcleo original se llama padre, mientras que el núcleo o núcleos resultantes se llaman hija o hijas. Es posible que las hijas sigan siendo radiactivas, que eventualmente se rompan en más partes, o que estén estables.
Lectura relacionada:
 Definición de Fuerza y Ejemplos (Ciencia)
Definición de Fuerza y Ejemplos (Ciencia)Tres Tipos de Desintegración Radiactiva
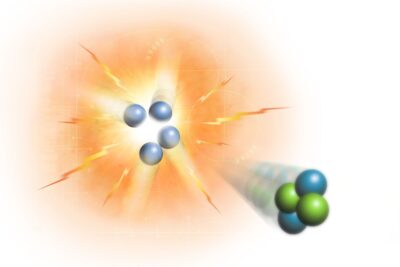
Hay tres formas de desintegración radiactiva: cuál de estas sufre un núcleo atómico depende de la naturaleza de la inestabilidad interna. Algunos isótopos pueden descomponerse a través de más de una vía.
Desintegración Alfa
En la desintegración alfa, el núcleo expulsa una partícula alfa, que es esencialmente un núcleo de helio (dos protones y dos neutrones), disminuyendo el número atómico del padre en dos y el número de masa en cuatro.
Desintegración Beta
En la desintegración beta, una corriente de electrones, llamadas partículas beta, son expulsadas del padre, y un neutrón en el núcleo se convierte en un protón. El número de masa del nuevo núcleo es el mismo, pero el número atómico aumenta en uno.
Lectura relacionada: Orbitales S P D F y Números Cuánticos de Momento Angular
Orbitales S P D F y Números Cuánticos de Momento AngularDesintegración Gamma
En la desintegración gamma, el núcleo atómico libera el exceso de energía en forma de fotones de alta energía (radiación electromagnética). El número atómico y el número másico siguen siendo los mismos, pero el núcleo resultante asume un estado de energía más estable.
Radiactivo vs. Estable
Un isótopo radiactivo es aquel que sufre desintegración radiactiva. El término "estable" es más ambiguo, ya que se aplica a elementos que no se separan, para fines prácticos, durante un largo período de tiempo. Esto significa que los isótopos estables incluyen aquellos que nunca se rompen, como el protio (consiste en un protón, por lo que no queda nada que perder), y los isótopos radiactivos, como el telurio -128, que tiene una vida media de 7,7 x 1024 años. Los radioisótopos con una vida media corta se denominan radioisótopos inestables.
Lectura relacionada: ¿Qué Es la Química Orgánica y Qué Hacen los Químicos?
¿Qué Es la Química Orgánica y Qué Hacen los Químicos?
Algunos Isótopos Estables Tienen Más Neutrones Que Protones
Se podría suponer que un núcleo en configuración estable tendría el mismo número de protones que de neutrones. Para muchos elementos más ligeros, esto es cierto. Por ejemplo, el carbono se encuentra comúnmente con tres configuraciones de protones y neutrones, llamados isótopos. El número de protones no cambia, ya que esto determina el elemento, pero sí el número de neutrones: el carbono 12 tiene seis protones y seis neutrones y es estable; el carbono 13 también tiene seis protones, pero tiene siete neutrones; el carbono 13 también es estable. Sin embargo, el carbono-14, con seis protones y ocho neutrones, es inestable o radiactivo. El número de neutrones para un núcleo de carbono-14 es demasiado alto para que la fuerte fuerza de atracción lo mantenga unido indefinidamente.
Pero, a medida que pasa a átomos que contienen más protones, los isótopos son cada vez más estables con un exceso de neutrones. Esto se debe a que los nucleones (protones y neutrones) no están fijos en su lugar en el núcleo, sino que se mueven, y los protones se repelen entre sí porque todos llevan una carga eléctrica positiva. Los neutrones de este núcleo más grande actúan para aislar a los protones de los efectos de los demás.
La Relación N: Z y los Números Mágicos
La relación de neutrones a protones, o relación N:Z, es el factor principal que determina si un núcleo atómico es estable o no. Los elementos más ligeros (Z < 20) prefieren tener el mismo número de protones y neutrones o N: Z = 1. Los elementos más pesados (Z = 20 a 83) prefieren una relación N: Z de 1,5 porque se necesitan más neutrones para aislar contra la fuerza repulsiva entre los protones.
También hay lo que se llama números mágicos, que son números de nucleones (protones o neutrones) que son especialmente estables. Si tanto el número de protones como el de neutrones tienen estos valores, la situación se denomina números mágicos dobles. Puede pensar en esto como el núcleo equivalente a la regla del octeto que rige la estabilidad de la capa de electrones. Los números mágicos son ligeramente diferentes para protones y neutrones:
- Protones: 2, 8, 20, 28, 50, 82, 114
- Neutrones: 2, 8, 20, 28, 50, 82, 126, 184
Para complicar aún más la estabilidad, hay más isótopos estables con Z:N par a par (162 isótopos) que par a impar (53 isótopos), que impar a par (50) que valores impar a impar (4).
Aleatoriedad y Desintegración Radiactiva
Una nota final: Si un núcleo sufre descomposición o no es un evento completamente aleatorio. La semivida de un isótopo es la mejor predicción para una muestra suficientemente grande de los elementos. No se puede usar para hacer ningún tipo de predicción sobre el comportamiento de un núcleo o unos pocos núcleos.
¿Puedes aprobar un examen sobre radiactividad?