La valoración conductométrica es un tipo de valoración en el que la conductividad electrolítica de una mezcla de muestra se determina de forma continua con la adición de un reactivo. El punto de equivalencia es la situación en la que la conductividad de la mezcla de reacción experimenta un repentino cambio. La conductividad eléctrica de la solución de muestra depende del número de iones libres de la muestra y de la carga paralela a cada uno de ellos. La conductometría tiene una aplicación importante en química analítica, donde una técnica estándar es la valoración conductométrica.
Tabla de contenidos
- ¿Qué es la valoración conductométrica?
- Principio de conductometría
- Tipo de valoración conductométrica
- Procedimiento de valoración conductométrica
- Aplicaciones de la valoración conductométrica
- Ventajas de la valoración conductométrica
- Inconvenientes de la valoración conductométrica
|
Principio de conductometría:
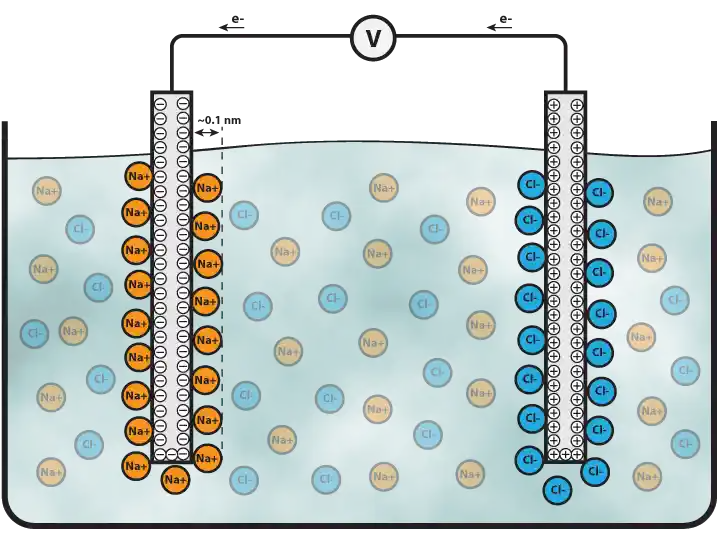
Para determinar la capacidad de una sustancia para llevar la corriente eléctrica, se utiliza la conductividad. La conductancia g de Siemens es la unidad básica y es el recíproco de la resistencia y que se determina en ohmios. La conductividad eléctrica de la muestra es proporcional al número de iones presentes en ella y, por tanto, el cálculo de conductividad de la solución proporcionará una lectura.
Principio de funcionamiento por el que se calcula la conductividad en el sistema simple. Dos placas de conductividad están situadas en la solución y potencialmente se aplican y, a continuación, se calcula la corriente (generalmente tensión alterna). A partir de los valores de corriente y tensión, puede encontrarse la conductividad. La conductividad precisa y constante puede medirse multiplicando la conductividad por la célula de electrodo.
Lectura relacionada: Principio y procedimiento del colorímetro
Principio y procedimiento del colorímetro
Esta conductividad constante viene determinada por la fórmula que se muestra a continuación,
Gt = Gt es necesario { 1 + a (t - t es necesario) }
Donde Gt es la conductividad a cualquier temperatura en °C
G tcal es la conductividad a una temperatura de calibración en °C
a es el coeficiente de temperatura de la solución
t es necesaria la temperatura de calibración.
Este ajuste puede realizarse manual o automáticamente calculando el coeficiente de temperatura de la solución con los conductímetros avanzados. La compensación automática de la temperatura con sensores de temperatura específicos es necesaria para una medida fiable de la conductancia, y la muestra y la solución estándar deben calibrarse con la misma temperatura.
Tipo de titulación conductométrica:
Por lo general, existen cinco tipos de valoración conductométrica, mencionados de la siguiente manera.
1. Valoración ácido-base: Es un proceso de análisis cuantitativo para determinar la concentración de ácido o base, neutralizándolo con precisión mediante una solución estándar con una concentración reconocida.
2. Valoración de precipitación: La valoración por precipitación es un método titrimétrico que implica la formación de precipitados durante todo el proceso de valoración.
3. Valoración de sustitución: El metal puede determinarse mediante este método cuando la valoración directa o posterior no proporciona un punto final preciso o cuando no existen indicadores adecuados para las moléculas.
4. Valoración redox (oxidación-reducción): Es un tipo de valoración de conductometría, la valoración redox es una reducción por un agente oxidante. Normalmente, esta valoración implica un potenciómetro o un indicador redox.
5. Valoración complexométrica: En esta valoración, el complejo de color se utiliza para determinar el punto final, éste es un tipo de análisis volumétrico.
Procedimiento de titulación conductométrica:
- Tomar 30 ml de HCL 0,001 M en un vaso de precipitados (100 ml).
- Llene la bureta con solución de NaOH.
- Encienda el conductímetro.
- Limpie la célula de conductividad y la sonda de temperatura con agua destilada y limpie suavemente con papel de seda.
- Sumerge la célula de conductividad en la solución de HCL.
- Pulse la tecla de conductividad.
- El dispositivo mostrará conducta.
- Mediante la mezcla continua, añada NaOH en HCl.
- Anote las lecturas.
- Trace la gráfica de la conductancia en función del volumen de NaOH.
- Apague el instrumento y limpie la celda de conductividad y la sonda de temperatura.
Aplicaciones de la titulación conductométrica:
- La conductometría también se utiliza para encontrar la concentración de salinidad y sólidos disueltos totales (TDS).
- La pureza del agua puede determinarse por conductometría.
- La solubilidad de sales poco solubles como el sulfato de plomo, el sulfato y el bario está determinada por la conductividad.
- La alcalinidad del agua dulce puede determinarse mediante este método.
- La valoración conductométrica tiene diversas aplicaciones en la valoración de precipitación, las valoraciones redox, la valoración ácido-base y las titulaciones complejas.
- Puede utilizarse para rastrear microorganismos.
- La conductometría se utiliza para controlar el progreso de una reacción química.
- El equilibrio químico en las reacciones iónicas puede determinarse por ello.
Las ventajas de la valoración conductométrica son las siguientes.
- La valoración conductométrica es sencilla y tiene una gran selectividad.
- También es adecuado para muestras complejas, como suspensión turbia, concentraciones bajas y soluciones coloreadas, etc.
- Ofrece resultados precisos con errores mínimos.
- La valoración conductométrica también es adecuada para ácidos débiles y soluciones más diluidas.
- El punto final de algunas muestras (de color o turbio) no se puede ver a simple vista. En este caso, se utiliza la valoración conductométrica.
- La temperatura permanece constante durante todo el proceso.
Lectura relacionada: Principio y aplicación de la polarimetría
Principio y aplicación de la polarimetría
Las desventajas de la valoración conductométrica son las siguientes.
- No es posible medir muestras con concentraciones elevadas mediante este método.
- Es menos preciso que otros métodos.
- Los cambios en los niveles de sal pueden aumentar la conductividad de la solución.
- Sólo puede realizarse un número limitado de valoraciones redox.
Las preguntas más frecuentes sobre la valoración conductométrica son las siguientes.
¿Qué es la conductometría?
La conductometría es la determinación de la conductividad electrolítica para observar el progreso de una reacción química. Generalmente se utiliza para medir la total conducción de una solución.
¿Cuál es el principio básico de la valoración conductométrica?
El principio principal implicado en la valoración conductométrica es que el movimiento de los iones produce conductividad eléctrica. El movimiento de los iones depende principalmente de la concentración de iones
¿Cuáles son los tipos de titulaciones conductométricas?
La valoración ácido-base, la valoración redox (oxidación-reducción), la valoración complexométrica por precipitación y la valoración de sustitución son los tipos de valoración conductométrica.
¿Cuál es la principal ventaja de la valoración conductométrica?
La principal ventaja de la valoración conductométrica es que puede determinar soluciones de color o turbias y puede trabajar con muchas soluciones diluidas y ácidos débiles.
¿Cuál es la diferencia principal entre la valoración conductométrica y la valoración potenciométrica?
La principal diferencia entre la valoración conductométrica y potenciométrica es que la valoración conductométrica determina la conductividad electrolítica de la solución de muestra, mientras que las titulaciones potenciométricas determinan el potencial de la solución de la muestra.
 Principio y procedimiento del colorímetro
Principio y procedimiento del colorímetro