Que diferencia principal entre ácido débil y ácido diluido es que El ácido débil es un compuesto que se disocia parcialmente cuando se disuelve en agua, mientras que el ácido diluido es una solución que contiene más agua que ácido..
Lectura relacionada: Diferencia entre etilmercurio y metilmercurio
Diferencia entre etilmercurio y metilmercurioUn ácido es un compuesto que puede disociarse en agua para liberar protones (iones de hidrógeno). Por lo tanto, los ácidos tienen un pH de menos de 7. Dependiendo de la fuerza del ácido, existen dos tipos de ácidos: ácidos fuertes y ácidos débiles. Pero según la concentración de ácido, hay dos tipos de solución ácida como ácido concentrado y ácido diluido.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es un ácido débil?
3. ¿Qué es el ácido diluido?
4. Comparación directa: ácido débil frente a ácido diluido en forma tabular
5. Resumen
¿Qué es un ácido débil?
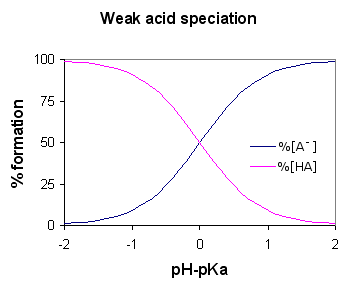
Un ácido débil es un compuesto que se disocia parcialmente en sus iones cuando se disuelve en agua. Un auxiliar débil es el ácido conjugado de una base débil. Además, un ácido débil tiene un pH alto en comparación con un adyuvante fuerte de la misma concentración. Cuando escribimos la ecuación química para la disociación de ácidos débiles, usamos una flecha doble para incluir tanto las reacciones directas como las inversas porque la disociación de ácidos débiles es reversible.
Lectura relacionada: Diferencia entre hidróxido de cobre y oxicloruro de cobre.
Diferencia entre hidróxido de cobre y oxicloruro de cobre.
Figura 01: Especiación de un ácido débil (AH es el ácido débil)
Un ácido débil se vuelve débil debido a la naturaleza menos polar del compuesto ácido; Si el compuesto es más polar, los protones pueden salir fácilmente de la molécula de ácido, pero aquí, como el compuesto es menos polar, es difícil romper los enlaces químicos. Algunos ejemplos de ácidos débiles son el ácido acético, el ácido fórmico, el ácido HF, el sulfuro de hidrógeno, etc.
Lectura relacionada: Diferencia entre aminoácidos zurdos y diestros
Diferencia entre aminoácidos zurdos y diestros¿Qué es el ácido diluido?
El ácido diluido es una solución acuosa con una baja concentración de ácido. Eso significa; La solución de ácido diluido tiene más agua en comparación con la acidez. El ácido diluido puede ser un ácido débil o un ácido fuerte. El término "diluido" solo describe la concentración del ácido. Lo opuesto al ácido diluido es el ácido concentrado.

Figura 02: Ácido HCl concentrado
Además, podemos diluir un ácido añadiendo más agua. Sin embargo, agregar agua a un ácido concentrado es peligroso. Por lo tanto, el método seguro es agregar ácido al agua. Diluir los ácidos es muy importante porque los ácidos muy concentrados pueden causar quemaduras graves si entran en contacto con la piel.
¿Cuál es la diferencia entre ácido débil y ácido diluido?
El ácido débil cae bajo la clasificación de fuerza ácida de los ácidos, mientras que el ácido diluido cae bajo la categoría de concentración de ácido. La diferencia clave entre el ácido débil y el ácido diluido es que el ácido débil es un compuesto que se disocia parcialmente cuando se disuelve en agua, mientras que el ácido diluido es una solución que contiene más agua que ácido. Sin embargo, la dilución del ácido no afecta la reactividad del ácido. Es decir, un ácido fuerte no se convierte en un ácido débil cuando se diluye. Pero los ácidos débiles son inherentemente menos reactivos.
La siguiente infografía resume la diferencia entre ácido débil y ácido diluido.

Resumen: ácido débil frente a ácido diluido
El ácido débil cae bajo la clasificación de fuerza ácida de los ácidos, y el ácido diluido cae bajo la categoría de concentración de ácidos. La diferencia clave entre el ácido débil y el ácido diluido es que el ácido débil es un compuesto que se disocia parcialmente cuando se disuelve en agua, mientras que el ácido diluido es una solución que contiene más agua que ácido.
Relación:
1. Helmenstine, Annemarie. "Definición y ejemplos de ácidos débiles en química". ThoughtCo, mayo. 5, 2019, Commons-Wikimedia.
Imagen de cortesía:
1. "Especiación de ácido débil" Por P. Gans, dibujo propio, quien lo subió fue Petergans en en.wikipedia - Transferido de en.wikipedia a Commons por LeaW (Dominio público) a través de Commons Wikimedia
2. "Ácido clorhídrico 05" (Dominio público) a través de Commons Wikimedia