Que diferencia principal entre ácido débil y fuerte es que Los ácidos débiles se ionizan parcialmente en agua, mientras que los ácidos fuertes se ionizan por completo.
Lectura relacionada: Diferencia entre erosión y corrosión.
Diferencia entre erosión y corrosión.La fuerza de un ácido es su capacidad para ionizar, o donar, el ion de hidrógeno en una solución acuosa que reacciona con el agua. Cuanto más se ioniza un ácido, más fuerte es, y la menor producción de iones de hidrógeno indica un ácido débil. Esta es la diferencia entre un ácido fuerte y un ácido débil. La concentración de iones en una solución acuosa de un ácido indica qué tan fuerte o débil es un ácido. Así que puedes tener una solución concentrada de un ácido débil y es completamente posible tener una solución diluida de un ácido fuerte.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es un ácido débil?
3. ¿Qué es un ácido fuerte?
4. Comparación lado a lado: ácido débil frente a ácido fuerte en forma tabular
5. Resumen
¿Qué es un ácido débil?
El ácido débil se refiere a los compuestos químicos que se disocian parcialmente en iones en una solución acuosa. No liberan la cantidad total de iones de hidrógeno liberables (H+) en la solución. Para estos ácidos, la constante de disociación ácida o Ka es un valor pequeño. El pH de estas soluciones es de alrededor de 3 a 5. Esto se debe principalmente a que estos ácidos débiles no pueden aumentar el contenido de iones de hidrógeno en la solución tanto como un ácido fuerte.
Lectura relacionada: Diferencia entre radiactividad natural y artificial.
Diferencia entre radiactividad natural y artificial.
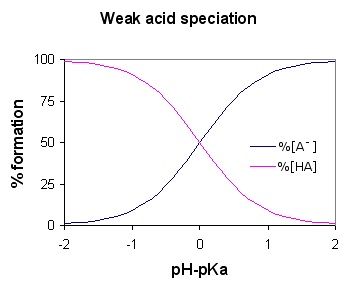
Figura 01: diagrama de especiación de ácido débil (para el ácido débil HA)
Como el ácido débil se disocia parcialmente, la solución acuosa contiene tres componentes principales; Iones de hidrógeno, moléculas de ácido unionizadas y la base conjugada (anión unido al ion de hidrógeno en la molécula de ácido). Algunos ejemplos comunes son el ácido sulfuroso, el ácido fosfórico, el ácido nitroso, etc.
Lectura relacionada: Diferencia entre oxidación y reducción.
Diferencia entre oxidación y reducción.¿Qué es un ácido fuerte?
El ácido fuerte se refiere a las moléculas que se disocian completamente en iones en una solución acuosa. Por lo tanto, estos compuestos se ionizan completamente en agua. El valor de la constante de disociación ácida o Ka es un valor alto para este tipo de ácido. Cuanto más fuerte es el ácido, más fácil es la liberación de iones de hidrógeno. Esto se debe principalmente a la alta polaridad del enlace HA, en el que H es hidrógeno y A es la base conjugada. Para ser altamente polar, la diferencia de electronegatividad entre los átomos a ambos lados de este enlace debe ser alta.

Figura 02: Estructura química del ácido fuerte HNO3 (ácido nítrico)
Además, esta liberación de iones de hidrógeno también depende del tamaño del anión (base conjugada) al que se une el ión de hidrógeno. Si el anión es grande y más estable, puede liberar fácilmente el ion de hidrógeno. A diferencia de los ácidos débiles, estos ácidos fuertes donan todos los iones de hidrógeno posibles a la solución acuosa. El pH de estas soluciones acuosas es muy bajo; puede variar de 1 a 3.
¿Cuál es la diferencia entre ácido débil y fuerte?
Los ácidos débiles se ionizan parcialmente en agua, mientras que los ácidos fuertes se ionizan por completo. Por lo tanto, la ionización es la diferencia clave entre el ácido débil y el ácido fuerte. Además, otra diferencia entre el ácido débil y el ácido fuerte es que el ácido débil no elimina todos los átomos de hidrógeno liberables. Por el contrario, el ácido fuerte libera todos los átomos de hidrógeno posibles.
Además, existe una diferencia entre la acidez débil y fuerte en función de su pH. Eso es; El pH de los ácidos débiles está entre 3 y 5 mientras que el pH de los ácidos fuertes está entre 1 y 3. Además, la constante de disociación ácida contribuye a otra diferencia entre ácido débil y fuerte. La constante de disociación ácida de un ácido débil es pequeña en comparación con la de un ácido fuerte.

Resumen - Ácido débil vs ácido fuerte
Los ácidos son moléculas que pueden donar iones de hidrógeno a una solución acuosa. Podemos dividir todos los ácidos en ácidos fuertes, ácidos medianamente fuertes y ácidos débiles. En resumen, la diferencia clave entre el ácido débil y el ácido fuerte es que los ácidos débiles se ionizan parcialmente en agua, mientras que los ácidos fuertes se ionizan por completo.
Relación:
1. Helmenstina, Anne Marie, Ph.D. "Lista de ácidos fuertes y débiles". ThoughtCo, 24 de septiembre de 2018. Disponible aquí
2. Helmenstina, Anne Marie, Ph.D. "Definición y ejemplos de ácidos débiles en química". ThoughtCo, 18 de junio de 2018. Disponible aquí
Imagen de cortesía:
1. "Especiación de ácido débil" por P. Gans y transmitido por LeaW., (Dominio público) a través de Commons Wikimedia
2. "CNX Chem 18 09 HNO3" Obtenido de OpenStax (CC BY 4.0) a través de Commons Wikimedia