Que diferencia principal entre actividad y volatilidad es que La actividad se refiere a la concentración efectiva de una especie química en condiciones no ideales, mientras que la fugacidad se refiere a la presión parcial efectiva de una especie química en condiciones no ideales.
Lectura relacionada: Diferencia entre oxicloruro de cobre y sulfato de cobre.
Diferencia entre oxicloruro de cobre y sulfato de cobre.La actividad y la volatilidad son conceptos químicos importantes en la termodinámica. Estos términos se definen para el comportamiento no ideal de los gases reales.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la actividad?
3. ¿Qué es la fugacidad?
4. Comparación lado a lado: actividad frente a fugacidad en forma tabular
5. Resumen
¿Qué es la actividad?
La actividad es la medida de la concentración efectiva de una especie química bajo un comportamiento no ideal. El concepto de actividad fue desarrollado por el químico estadounidense Gilbert N. Lewis. La actividad es una cantidad adimensional. El valor de la actividad para una conexión determinada depende del estado predeterminado de ese tipo. Por ejemplo, se supone que el valor de las sustancias en fase sólida o líquida es 1. Para los gases, la actividad se refiere a la presión parcial efectiva, es decir, la fugacidad/presión del gas que estamos considerando. Además, la actividad depende de los siguientes factores:
Lectura relacionada: Diferencia entre la reacción de Sandmeyer y la reacción de Gattermann
Diferencia entre la reacción de Sandmeyer y la reacción de Gattermann- la temperatura
- Impresión
- composición de la mezcla, etc.
Eso significa; el ambiente afecta la actividad de una especie química. En condiciones menos que ideales, las moléculas de gas tienden a interactuar entre sí atrayéndose o repeliéndose. Por lo tanto, la actividad de una molécula o ion está influenciada por las especies químicas presentes en su entorno.
¿Qué es la fugacidad?
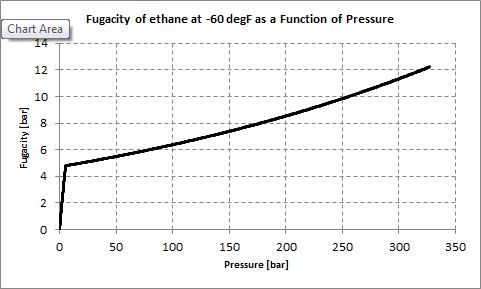
La fugacidad es una medida de la presión parcial efectiva de una especie química en condiciones no ideales. El valor de volatilidad para una especie química dada como un gas real es igual a la presión de un gas ideal cuya temperatura y energía libre molar son iguales a las del gas real. Podemos determinar la fugacidad usando un método experimental o usando otro modelo como el gas de van der Waals (que corresponde más a un gas real que a un gas ideal).
El coeficiente de fugacidad es la relación entre la presión de un gas real y su fugacidad. Lo podemos denotar con el símbolo ϕ. la relacion es
Lectura relacionada: Diferencia entre SO2 y SO3
Diferencia entre SO2 y SO3ϕ = f/P
donde f es la volatilidad mientras que P es la presión del gas real. Para un gas ideal, los valores de presión y volatilidad son iguales. Por tanto, el coeficiente de fugacidad de un gas ideal es 1.

Figura 01: Fugacidad del etano.
Además, esta noción de volatilidad está íntimamente relacionada con la actividad o actividad termodinámica. Podemos enunciar esta relación, actividad = volatilidad/presión.
¿Cuál es la diferencia entre actividad y fugacidad?
los diferencia principal entre actividad y fugacidad es que la actividad se refiere a la concentración efectiva de una especie química en condiciones no ideales, mientras que la fugacidad se refiere a la presión parcial efectiva de una especie química en condiciones no ideales. Por tanto, conceptualmente, la actividad termodinámica es la concentración efectiva de moléculas reales, es decir, gases reales, mientras que la fugacidad es la presión parcial efectiva de los gases reales. Además, podemos determinar la volatilidad usando un método experimental o usando otro modelo como el gas de van der Waals (que corresponde más a un gas real que a un gas ideal) y este valor corresponde a la actividad * la presión del gas real.
La siguiente infografía resume la diferencia entre actividad y volatilidad.

Resumen: actividad frente a fugacidad
La actividad y la volatilidad son conceptos químicos importantes en la termodinámica. En resumen, la principal diferencia entre actividad y fugacidad es que la actividad se refiere a la concentración efectiva de una especie química en condiciones no ideales, mientras que la fugacidad se refiere a la presión parcial efectiva de una especie química en condiciones no ideales.
Relación:
1. Jones, Andrew Zimmermann. "Leyes de la Termodinámica". ThoughtCo, 7 de septiembre de 2019, disponible aquí.
Imagen de cortesía:
1. "Fugacidad frente a la presión del etano a -60 °F" por Stieltjes: gráfico de Excel con Peng-Robinson EOS (CC BY-SA 3.0) a través de Commons Wikimedia