Que diferencia principal entre SO2 y SO3 es que ASI QUE2 es un gas incoloro a temperatura ambiente, mientras que SO3 es un sólido cristalino de incoloro a blanco.
ASI QUE2 El dióxido de azufre es mientras SO3 es trióxido de azufre. Ambos son óxidos de azufre.
Lectura relacionada: Diferencia entre metilamina y dimetilamina.
Diferencia entre metilamina y dimetilamina.CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es el SO2?
3. ¿Qué es el SO3?
4. Comparación lado a lado - SO2 vs. SO3 en forma tabular
5. Resumen
¿Qué es el SO2?
ASI QUE2 es dióxido de azufre. Es un compuesto gaseoso incoloro que contiene átomos de azufre y oxígeno. ASI QUE2 es la fórmula química de este compuesto. Por lo tanto, contiene un átomo de azufre unido a dos átomos de oxígeno a través de enlaces covalentes. Un átomo de oxígeno puede formar un doble enlace con el átomo de azufre. Así, el átomo de azufre es el átomo central del compuesto. El átomo de azufre tiene 6 electrones en su orbital más externo. Por tanto, tras la formación de dos dobles enlaces con los átomos de oxígeno, quedan dos electrones más; estos electrones existen como un par solitario de electrones.
Con esto podemos determinar la geometría de la RO2 Molécula; es geometría angular. ASI QUE2 es polar debido a su geometría (angular) y la presencia de un par de electrones solitario.
Lectura relacionada: Diferencia entre reacción de turno simple y turno doble
Diferencia entre reacción de turno simple y turno doble
Figura 01: Estructura del dióxido de azufre
El dióxido de azufre se considera un gas tóxico. Entonces, si el SO2 está presente en la atmósfera, es una indicación de contaminación del aire. Además, este gas tiene un olor muy irritante. La masa molecular del dióxido de azufre es de 64 g/mol. Es un gas incoloro a temperatura ambiente. El punto de fusión es de alrededor de -71°C mientras que el punto de ebullición es de alrededor de -10°C.
Lectura relacionada: Diferencia entre etilamina y dietilamina.
Diferencia entre etilamina y dietilamina.El estado de oxidación del azufre en el dióxido de azufre es +4. Por lo tanto, el dióxido de azufre también se puede producir mediante la reducción de compuestos compuestos por átomos de azufre que se encuentran en un estado de oxidación más alto. Un ejemplo de ello es la reacción entre el cobre y el ácido sulfúrico. El azufre en ácido sulfúrico tiene el estado de oxidación +6. Por lo tanto, se puede reducir al estado de oxidación +4 del dióxido de azufre.
El dióxido de azufre se puede utilizar en la producción de ácido sulfúrico, que tiene varios usos a escala industrial y de laboratorio. El dióxido de azufre también es un buen agente reductor. Dado que el estado de oxidación del azufre en el dióxido de azufre es +4, puede oxidarse fácilmente a un estado de oxidación +6, lo que puede reducir otro compuesto.
¿Qué es el SO3?
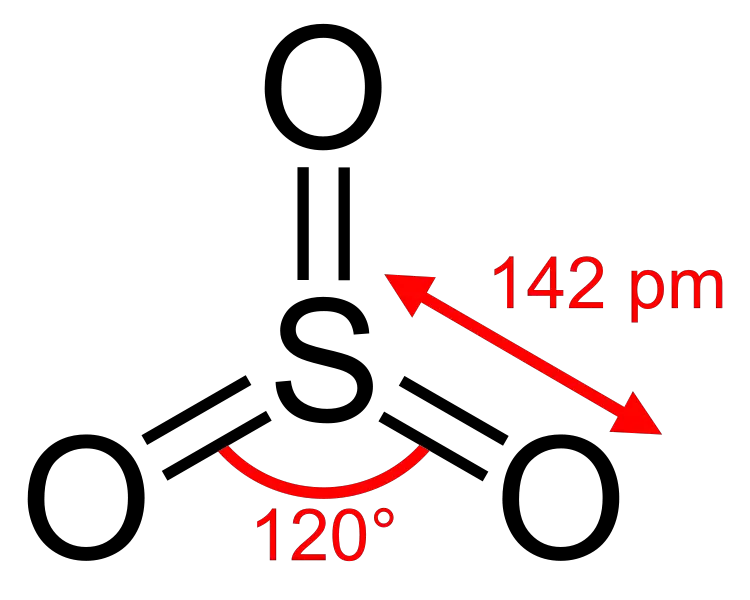
ASI QUE3 es trióxido de azufre. Es un compuesto sólido que contiene un átomo de azufre unido a tres átomos de oxígeno. ASI QUE3 es la fórmula química de este compuesto. Cada átomo de oxígeno tiene un doble enlace con el átomo de azufre. El átomo de azufre está en el centro de la molécula. Un átomo de azufre tiene 6 electrones en su orbital más externo. Después de la formación de tres dobles enlaces con los átomos de oxígeno, no quedan más electrones en el átomo de azufre, como es el caso del dióxido de azufre. Por lo tanto, esto determina la geometría de la RO3 Molécula; tiene una geometría plana trigonal. ASI QUE3 es no polar debido a su geometría (planar trigonal) y la falta de un par de electrones solitario.

Figura 02: Geometría del trióxido de azufre
La masa molar del trióxido de azufre es 80,057 g/mol. El punto de fusión del SO3 es de unos 16,9 °C, mientras que el punto de ebullición es de 45 °C. A temperatura y presión ambiente, el trióxido de azufre es un compuesto sólido, cristalino y blanco que emite vapores en el aire. Tiene un olor acre. El estado de oxidación del azufre en el trióxido de azufre es +6.
En forma gaseosa, el trióxido de azufre es un contaminante del aire y un componente principal de la lluvia ácida. Sin embargo, el trióxido de azufre es muy importante en la producción a escala industrial de ácido sulfúrico. Esto se debe a que el trióxido de azufre es la forma de anhídrido del ácido sulfúrico.
ASI QUE3 (l) +H2O(l) → h2ASI QUE4(l)
La reacción anterior es muy rápida y exotérmica. Por lo tanto, se deben aplicar métodos de control cuando se usa trióxido de azufre para la producción industrial de ácido sulfúrico. Además, el trióxido de azufre es un reactivo esencial en el proceso de sulfonación.
¿Cuál es la diferencia entre SO2 y SO3?
ASI QUE2 El dióxido de azufre es mientras SO3 es trióxido de azufre. Ambos son óxidos de azufre. La principal diferencia entre SO2 y SO3 es el SO2 es un gas incoloro a temperatura ambiente, mientras que SO3 es un sólido cristalino de incoloro a blanco. Además, el estado de oxidación del azufre en el dióxido de azufre es +4 mientras que en el trióxido de azufre es +6. Debido a la presencia de un par solitario de electrones y su geometría, el dióxido de azufre es un compuesto polar mientras que el trióxido de azufre es un compuesto no polar. La siguiente infografía resume la diferencia entre SO2 y SO3.

Resumen: SO2 frente a SO3
ASI QUE2 es dióxido de azufre, y SO3 es trióxido de azufre. Ambos son óxidos de azufre. La principal diferencia entre SO2 y SO3 es el SO2 es un gas incoloro a temperatura ambiente, mientras que SO3 es un sólido cristalino de incoloro a blanco.
Relación:
1. Brandt, Malcolm J., et al. "Almacenamiento, dosificación y control de productos químicos", Tworts Water Supply, 2017, págs.
Imagen de cortesía:
1. "Dióxido de azufre-2D" por el cargador original fue Richtom80 en Wikipedia en inglés. – Transferido de en.wikipedia a Commons (dominio público) a través de Commons Wikimedia
2. "Sulphur-trioxide-2D-dimensions" por Jynto - Trabajo propio, basado en File:Sulphur-trioxide-2D-dimensions.png (Dominio público) a través de Commons Wikimedia