Que diferencia principal entre la capacidad calorífica y el calor específico La capacidad calorífica depende de la cantidad de sustancia, mientras que la capacidad calorífica específica es independiente de ella..
Lectura relacionada:Diferencia entre líquido y acuoso.Cuando calentamos una sustancia, su temperatura aumenta, y cuando la enfriamos, su temperatura disminuye. Esta diferencia de temperatura es proporcional a la cantidad de calor suministrado. La capacidad calorífica y el calor específico son dos constantes de proporcionalidad relacionadas con el cambio de temperatura y la cantidad de calor.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la capacidad calorífica?
3. ¿Qué es el calor específico?
4. Comparación lado a lado: capacidad calorífica frente a calor específico en forma tabular
5. Resumen
¿Qué es la capacidad calorífica?
En termodinámica, la energía total de un sistema es la energía interna. La energía interna da la energía cinética y potencial total de las moléculas en el sistema. Podemos cambiar la energía interna de un sistema haciendo trabajo sobre el sistema o calentándolo. La energía interna de una sustancia aumenta cuando aumentamos su temperatura. La cantidad de aumento depende de las condiciones bajo las cuales tiene lugar el calentamiento. Aquí necesitamos calor para elevar la temperatura.
Lectura relacionada: diferencia entre agua y hielo
diferencia entre agua y hieloLa capacidad calorífica (C) de una sustancia es “la cantidad de calor necesaria para elevar la temperatura de una sustancia en un grado Celsius (o un Kelvin)”. La capacidad calorífica varía de una sustancia a otra. La cantidad de sustancia es directamente proporcional a la capacidad calorífica. Esto significa que al duplicar la masa de una sustancia se duplica su capacidad calorífica. El calor que necesitamos para elevar la temperatura de t1 a t2 de una sustancia se puede calcular usando la siguiente ecuación.
q= C x ∆t
q= calor requerido
∆t=t1-t2
 Lectura relacionada:
Lectura relacionada: Diferencia entre peróxido y peróxido de hidrógeno.
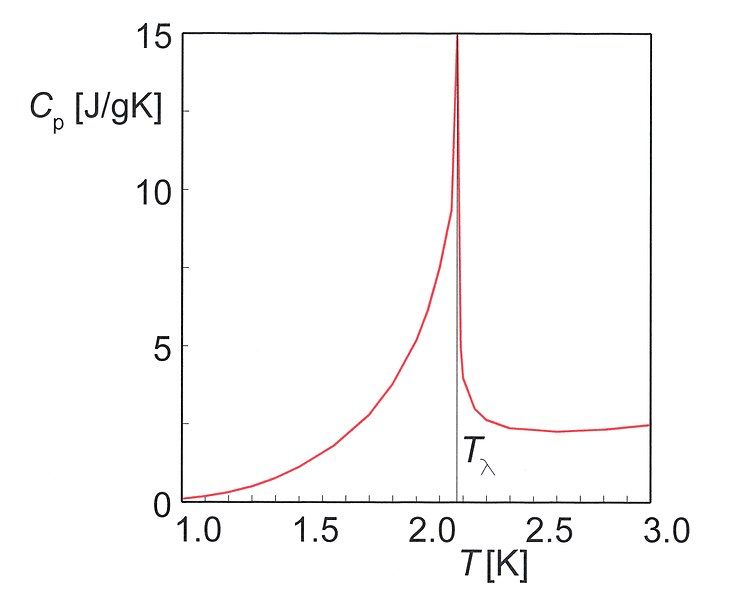
Diferencia entre peróxido y peróxido de hidrógeno.Figura 01: Capacidad calorífica del helio
La unidad de capacidad calorífica es JºC-1 o JK-1. En termodinámica, se definen dos tipos de capacidades caloríficas; capacidad calorífica a presión constante y capacidad calorífica a volumen constante.
¿Qué es el calor específico?
La capacidad calorífica depende de la cantidad de sustancia. El calor específico o capacidad calorífica específica (s) es la capacidad calorífica que es independiente de la cantidad de sustancia. Podemos definirlo como "la cantidad de calor requerida para elevar la temperatura de un gramo de una sustancia en un grado Celsius (o un Kelvin) a presión constante".
La unidad de calor específico es Jg-1oC-1. El calor específico del agua es muy alto con un valor de 4.186 Jg-1oC-1. Esto significa que para calentar 1 g de agua en 1 °C, necesitamos 4,186 J de energía térmica. Este alto valor explica el papel del agua en la termorregulación. Para encontrar el calor requerido para elevar la temperatura de una masa dada de sustancia de t1 a t2, se puede usar la siguiente ecuación.
q=mxsx∆t
q= calor requerido
m= masa de sustancia
∆t=t1-t2
Sin embargo, la ecuación anterior no se aplica cuando la reacción implica un cambio de fase; por ejemplo, cuando el agua se convierte en una fase gaseosa (en el punto de ebullición) o cuando el agua se congela para formar hielo (en el punto de fusión). Esto se debe a que el calor agregado o eliminado durante el cambio de fase no cambia la temperatura.
¿Cuál es la diferencia entre capacidad calorífica y calor específico?
La diferencia clave entre la capacidad calorífica y el calor específico es que la capacidad calorífica depende de la cantidad de sustancia, mientras que la capacidad calorífica específica es independiente de ella. Mirando la teoría, la capacidad calorífica es la cantidad de calor necesaria para cambiar la temperatura de una sustancia en 1 °C o 1 K, mientras que el calor específico es el calor necesario para cambiar la temperatura de una sustancia en 1 g para cambiar en 1 ° C o 1K.

Resumen: capacidad calorífica frente a calor específico
La capacidad calorífica y el calor específico son términos importantes en termodinámica. La diferencia clave entre la capacidad calorífica y el calor específico es que la capacidad calorífica depende de la cantidad de sustancia, mientras que la capacidad calorífica específica es independiente de ella.
Relación:
1. Helmenstine, Anne Marie. "Capacidad calorífica específica en química". ThoughtCo, 21 de marzo de 2019, disponible aquí.
Imagen de cortesía:
1. "Capacidad de calor de 4He 01" por Adwaele en Wikipedia en inglés (CC BY-SA 3.0) a través de Commons Wikimedia