
Que diferencia principal entre el carbonato de calcio y el óxido de calcio es que El carbonato de calcio tiende a descomponerse cuando se calienta a altas temperaturas, mientras que el óxido de calcio es muy estable al tratamiento térmico..
Lectura relacionada: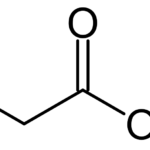 Diferencia entre cipionato y propionato.
Diferencia entre cipionato y propionato.El carbonato de calcio y el óxido de calcio son compuestos inorgánicos importantes del calcio metálico. Estas sustancias tienen diversos usos en la industria.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es el carbonato de calcio?
3. ¿Qué es el óxido de calcio?
4. Comparación lado a lado: carbonato de calcio frente a óxido de calcio en forma tabular
5. Resumen
¿Qué es el carbonato de calcio?
El carbonato de calcio es un carbonato de calcio con la fórmula química CaCO3. Este compuesto ocurre naturalmente como piedra caliza, tiza, calcita, etc. Por lo tanto, es una sustancia común en las rocas. Ejemplo: calcita o aragonito (la caliza contiene ambas formas). El carbonato de calcio se presenta como polvo o cristales hexagonales blancos y es inodoro.
Lectura relacionada: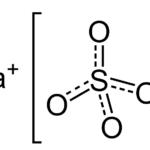 Diferencia entre sulfato de amonio y sulfato de sodio.
Diferencia entre sulfato de amonio y sulfato de sodio.
Figura 01: Aspecto del carbonato de calcio.
Además, el carbonato de calcio tiene un sabor a tiza. La masa molar de este compuesto es de 100 g/mol y el punto de fusión es de 1339 °C (para la forma de calcita). Sin embargo, no tiene punto de ebullición porque este compuesto se descompone a altas temperaturas. Podemos obtener este compuesto descomponiendo los minerales que contienen calcio. Pero esta forma no es pura. Podemos obtener una forma pura usando una fuente pura como el mármol. Cuando el carbonato de calcio reacciona con los ácidos, forma CO2 Gas. Cuando reacciona con el agua, forma hidróxido de calcio. Además, puede descomponerse térmicamente, liberando CO2 Gas.
Lectura relacionada: Diferencia entre acetato y triacetato.
Diferencia entre acetato y triacetato.¿Qué es el óxido de calcio?
El óxido de calcio es un compuesto inorgánico con la fórmula química CaO. También se le llama cal quemada o cal quemada. Podemos describir esta sustancia como un compuesto blanco, cáustico, alcalino y cristalino. También es inodoro.

Figura 02: Apariencia del Óxido de Calcio
En la producción de óxido de calcio, esta sustancia se produce generalmente por descomposición térmica de piedra caliza o conchas marinas que contienen carbonato de calcio en un horno de cal. En este proceso de preparación, necesitamos calentar los reactivos a una temperatura de más de 625 grados centígrados. Este tratamiento térmico se llama calcinación. Este proceso libera dióxido de carbono molecular, que deja atrás la cal viva. Dado que la cal viva no es estable, puede reaccionar espontáneamente con el dióxido de carbono cuando se enfría y, después de un tiempo suficiente, se convierte completamente de nuevo en carbonato de calcio. Por lo que tenemos que desmoldarlo con agua para fijarlo como revoque de cal o mortero de cal.
Teniendo en cuenta los usos del óxido de calcio, el uso principal es en el proceso básico de fabricación de acero con oxígeno, donde puede neutralizar los óxidos ácidos, el óxido de silicio, el óxido de aluminio y el óxido de hierro, produciendo así una escoria fundida. Otra aplicación importante del óxido de calcio es en la producción de bloques de hormigón celular de diferentes densidades.
¿Cuál es la diferencia entre el carbonato de calcio y el óxido de calcio?
El carbonato de calcio es un carbonato de calcio con la fórmula química CaCO3, mientras que el óxido de calcio es un compuesto inorgánico con la fórmula química CaO. La principal diferencia entre el carbonato de calcio y el óxido de calcio es que el carbonato de calcio tiende a descomponerse cuando se calienta a altas temperaturas, mientras que el óxido de calcio es muy estable al tratamiento térmico.
A continuación se muestran las diferencias entre el carbonato de calcio y el óxido de calcio en forma tabular.

Resumen: carbonato de calcio frente a óxido de calcio
El carbonato de calcio y el óxido de calcio son compuestos inorgánicos importantes del calcio metálico. La principal diferencia entre el carbonato de calcio y el óxido de calcio es que el carbonato de calcio tiende a descomponerse cuando se calienta a altas temperaturas, mientras que el óxido de calcio es muy estable al tratamiento térmico.
Relación:
1. Giammaria, Guido y Leon Lefferts. "Efecto catalítico del agua sobre la descomposición del carbonato de calcio". Diario de uso de CO2Elsevier, 4 de julio de 2019, disponible aquí.
Imagen de cortesía:
1. "Carbonato de calcio" de la imagen tomada en agosto de 2005 por Usuario: Walkerma (Dominio público) a través de Commons Wikimedia
2. "Polvo de óxido de calcio" por Leiem - Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia











