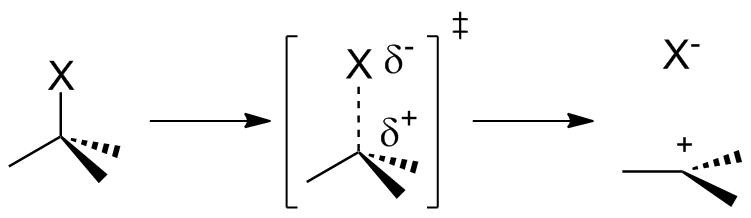Que diferencia principal entre protonación e ionización es que La protonación es la adición de un protón a una especie química, mientras que la ionización es la eliminación o ganancia de electrones de una especie química..
Lectura relacionada: Diferencia entre urea y tiourea.
Diferencia entre urea y tiourea.La protonación y la ionización son dos conceptos químicos que son importantes para describir el comportamiento iónico de las especies químicas.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la protonación?
3. ¿Qué es la ionización?
4. Comparación lado a lado: protonación frente a ionización en forma tabular
5. Resumen
¿Qué es la protonación?
La protonación es la adición de un protón a una especie química como un átomo, una molécula o un ion. Esto forma el ácido conjugado de la especie química correspondiente. La protonación se puede describir como una reacción química fundamental y es un paso importante en muchos procesos estequiométricos y catalíticos.
Lectura relacionada: Diferencia entre carbonato de calcio y óxido de calcio.
Diferencia entre carbonato de calcio y óxido de calcio.
Figura 01: Una reacción de protonación.
Hay dos tipos de procesos de protonación conocidos como protonación monobásica y protonación polibásica. Protonación monobásica es la protonación única que tiene lugar en algunos iones y moléculas. Pero en algunos iones y moléculas puede haber más de una protonación y podemos llamarlas especies químicas polibásicas. Esta naturaleza polibásica se aplica a muchas macromoléculas biológicas.
Lectura relacionada: Diferencia entre cipionato y propionato.
Diferencia entre cipionato y propionato.¿Qué es la ionización?
La ionización es un proceso químico en el que los átomos o moléculas adquieren una carga positiva o negativa. Este proceso ocurre eliminando o reteniendo electrones de átomos o moléculas. En ionización, podemos llamar aniones y cationes a los iones resultantes dependiendo de su carga, es decir, los cationes son iones cargados positivamente y los aniones son iones cargados negativamente. Básicamente, la pérdida de electrones de un átomo o molécula neutra forma un catión, y la ganancia de electrones de un átomo neutro le da una carga negativa, formando un anión.
Cuando se elimina un electrón de un átomo gaseoso neutro mediante el suministro de energía, forma un catión monovalente. Esto se debe a que un átomo neutro tiene el mismo número de electrones y protones, por lo que no tiene carga neta; Si le quitamos un electrón a este átomo, hay un protón en exceso al que le falta un electrón para neutralizar su carga. Por lo tanto, este átomo recibe una carga de +1 (es la carga del protón). La cantidad de energía requerida para esto es la primera energía de ionización de ese átomo.

Figura 02: Reacción de ionización
Además, la ionización que tiene lugar en una solución líquida es la formación de iones en la solución. Por ejemplo, cuando las moléculas de HCl se disuelven en agua, se forman iones hidronio (H3O+). Aquí, el HCl reacciona con las moléculas de agua para formar iones hidronio con carga positiva y cloruro con carga negativa (Cl–) iones.
Los impactos también pueden causar ionización. Sin embargo, este tipo de ionización ocurre principalmente en gases cuando una corriente eléctrica fluye a través del gas. Cuando los electrones en la corriente tienen una cantidad suficiente de energía requerida para eliminar electrones de las moléculas de gas, empujarán los electrones fuera de las moléculas de gas y crearán pares de iones formados por el único ion positivo y el electrón negativo. Los iones negativos también se forman aquí porque algunos electrones tienden a unirse a las moléculas de gas en lugar de extraer electrones.
Además, la ionización ocurre cuando la energía radiante o partículas suficientemente energéticas pasan a través de sólidos, líquidos o gases; por ejemplo, las partículas alfa, las partículas beta y los rayos gamma pueden ionizar sustancias; por eso lo llamamos radiación ionizante.
¿Cuál es la diferencia entre protonación e ionización?
La protonación y la ionización son conceptos químicos importantes en química. los diferencia clave entre protonación e ionización es que la protonación es la adición de un protón a una especie química, mientras que la ionización es la eliminación o ganancia de electrones de especies químicas.
La siguiente infografía resume las diferencias entre protonación e ionización en forma tabular.

Resumen: protonación frente a ionización
La protonación y la ionización son opuestos entre sí, ya que la protonación está relacionada con la adición, mientras que la ionización está relacionada principalmente con la ruptura de enlaces. los diferencia clave entre protonación e ionización es que la protonación es la adición de un protón a una especie química, mientras que la ionización es la eliminación o ganancia de electrones de especies químicas.
Relación:
1. "Ionización". Enciclopedia BritánicaEncyclopædia Britannica, Inc., disponible aquí.
Imagen de cortesía:
1. "Protonation d'un alcool tertiaire" Por El cargador original fue Rhadamante en Wikipedia en francés. – Transferido de fr.Wikipedia a Commons por Bloody-libu usando CommonsHelper. (CC BY-SA 3.0) a través de Commons Wikimedia
2. "Reacción de ionización" por Cseizert - Trabajo propio (CC BY-SA 3.0) a través de Commons Wikimedia