Que diferencia principal entre conexiones hipervalentes e hipovalentes Los compuestos hipervalentes contienen un átomo central con más de ocho electrones en la capa de electrones de valencia, mientras que los compuestos hipovalentes contienen un átomo central con menos de ocho electrones en la capa de electrones de valencia.
Lectura relacionada: Diferencia entre la regla de Saytzeff y la de Hofmann
Diferencia entre la regla de Saytzeff y la de HofmannLos términos hipervalente e hipovalente se refieren a compuestos covalentes inorgánicos que contienen un átomo central. Estos dos tipos de compuestos difieren según la cantidad de electrones en el átomo central: los compuestos hipervalentes tienen un octeto completo, mientras que los compuestos hipovalentes no.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué son los compuestos hipervalentes?
3. ¿Qué son los compuestos hipovalentes?
4. Comparación lado a lado: compuestos hipervalentes e hipovalentes en forma tabular
5. Resumen
¿Qué son los compuestos hipervalentes?
Los compuestos hipervalentes son especies químicas que contienen un átomo central con más de ocho electrones en la capa de electrones de valencia. También lo llamamos octeto extendido. El primer científico en definir este tipo de molécula fue Jeremy I. Musher en 1969. Existen varias clases de compuestos hipervalentes como los compuestos de yodo hipervalente, compuestos de gases nobles como los compuestos de xenón, halopolifluoruros, etc.
Lectura relacionada: Diferencia entre complejos de alto y bajo espín
Diferencia entre complejos de alto y bajo espín
Figura 01: Conexiones hipervalentes
El enlace químico en compuestos hipervalentes se puede describir utilizando la teoría de orbitales moleculares. Tomemos, por ejemplo, el compuesto de hexafluoruro de azufre, tiene seis átomos de flúor unidos a un átomo de azufre por enlaces simples. Por lo tanto, hay 12 electrones alrededor del átomo de azufre. Según la teoría de los orbitales moleculares, el orbital 3s, tres orbitales 3p y seis orbitales 2p de cada átomo de flúor contribuyen a la formación de este compuesto. Un total de diez orbitales atómicos están involucrados en la formación del compuesto. De acuerdo con las configuraciones electrónicas de azufre y flúor, hay espacio para 12 electrones de valencia. Debido a que hay 12 electrones, el compuesto de hexafluoruro de azufre es un compuesto hipervalente.
Lectura relacionada: Diferencia entre ácido isoftálico y ácido tereftálico
Diferencia entre ácido isoftálico y ácido tereftálico¿Qué son los compuestos hipovalentes?
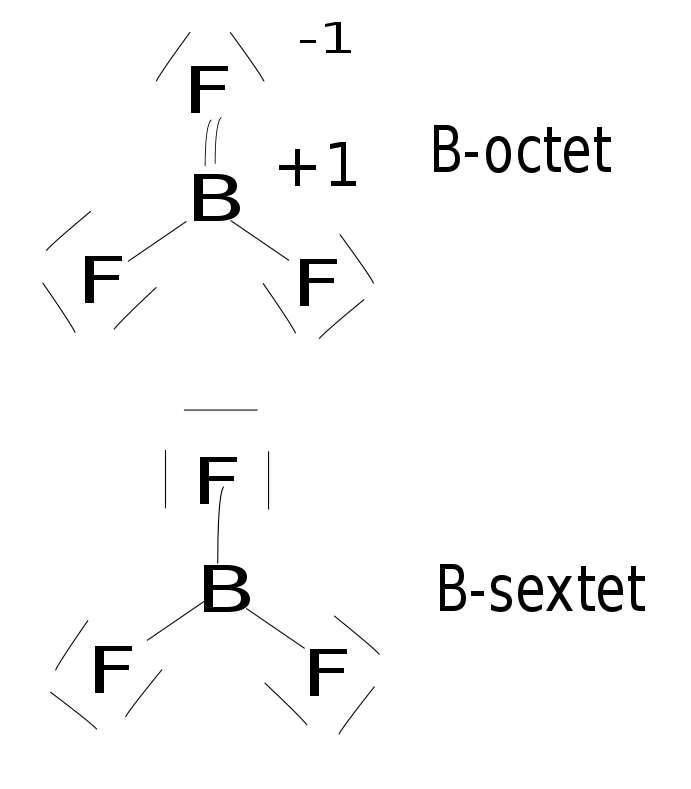
Los compuestos hipovalentes son especies químicas que contienen un átomo central con menos de ocho electrones en la capa de electrones de valencia. Por lo tanto, estos se conocen como especies pobres en electrones. A diferencia de los compuestos hipervalentes, casi todos los compuestos hipovalentes son especies no iónicas. Por lo tanto, en su mayoría son compuestos molidos o granulares.

Figura 02: el trifluoruro de boro es un compuesto hipovalente
Estos enlaces covalentes no llevan más de cuatro enlaces simples covalentes a su alrededor, ya que cuatro enlaces covalentes se refieren a ocho electrones. Además, las formas de las conexiones covalentes son en su mayoría planas lineales o trigonales.
¿Cuál es la diferencia entre compuestos hipervalentes e hipovalentes?
los diferencia principal entre los compuestos hipervalentes e hipovalentes es que los compuestos hipervalentes son especies químicas que contienen un átomo central con más de ocho electrones en la capa de electrones de valencia, mientras que los compuestos hipovalentes son especies químicas que contienen un átomo central con menos de ocho electrones en la capa de electrones de valencia. Además, la mayoría de los compuestos hipervalentes son especies iónicas, mientras que casi todos los compuestos hipovalentes son compuestos covalentes.
Además, las formas de enlaces hipervalentes covalentes son estructuras tetragonales o más complejas, mientras que los enlaces hipovalentes no pueden formar estructuras complicadas; son planos lineales o trigonales. Por lo tanto, esta también es una diferencia significativa entre las conexiones hipervalentes e hipovalentes. Además, hay más de cuatro enlaces covalentes alrededor del átomo central de los compuestos hipervalentes, pero hay dos o tres enlaces covalentes alrededor del átomo central de los compuestos hipovalentes.

Resumen: conexiones hipervalentes frente a hipovalentes
Los términos hipervalente e hipovalente describen compuestos covalentes inorgánicos que contienen un átomo central. los diferencia clave entre los compuestos hipervalentes e hipovalentes es que los compuestos hipervalentes son especies químicas que contienen un átomo central con más de ocho electrones en la capa de electrones de valencia, pero los compuestos hipovalentes son especies químicas que contienen un átomo central con menos de ocho electrones en la valencia capa electrónica.
Relación:
1. "Molécula hipervalente". WikipediaFundación Wikimedia, 18 de enero de 2020, disponible aquí.
Imagen de cortesía:
1. "Cálculos gamma de hipervalencia" por Marcus Durrant - Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia
2. "BF3-Lewis" por Jcwf en Wikilibros holandeses (CC BY-SA 2.5) a través de Commons Wikimedia