Que diferencia principal entre el lugar de la red y el lugar intersticial es que el sitio de la red es la posición de las partículas constituyentes en la red cristalina, mientras que el sitio intersticial es una posición entre posiciones regulares en la disposición de los constituyentes del cristal que pueden ser ocupadas por otras partículas.
Lectura relacionada:Las redes cristalinas son arreglos de partículas (como átomos, iones o moléculas) en cristales. Los cristales son un material sólido que tiene las partículas de una manera muy ordenada. Hay varios términos que podemos discutir en relación con una red cristalina: sitio de red, sitio intersticial, cavidad, defectos de cristal se encuentran entre estos términos.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es un sitio de celosía?
3. ¿Qué es un sitio intersticial?
4. Comparación lado a lado: sitio de celosía versus sitio intersticial en forma tabular
5. Resumen
¿Qué es un sitio de celosía?
El sitio de la red es la posición de las partículas constituyentes, átomos, moléculas o iones en una red cristalina. Por lo tanto, un sitio de celosía contiene una serie de puntos que tienen una disposición de un patrón específico con alta simetría. Solo podemos observar un sitio de red a través de un microscopio porque es pequeño y no se puede ver a simple vista.
Lectura relacionada: Diferencia entre el nitrato de calcio y amonio y el nitrato de amonio.
Diferencia entre el nitrato de calcio y amonio y el nitrato de amonio.Las posiciones de la red están ocupadas por átomos, iones o moléculas del cristal; estos son del mismo tipo o de diferentes tipos. Además, si los sitios de la red contienen átomos del mismo tipo, se habla de una red cristalina monoatómica, y si hay diferentes tipos de átomos, entonces de una red cristalina poliatómica. A menudo, las redes cristalinas monoatómicas son simples en comparación con los cristales poliatómicos. Las redes poliatómicas son redes compuestas. La sal de mesa o NaCl, por ejemplo, es una red compuesta cuyos sitios de red están ocupados por átomos de sodio (Na) y cloro (Cl).

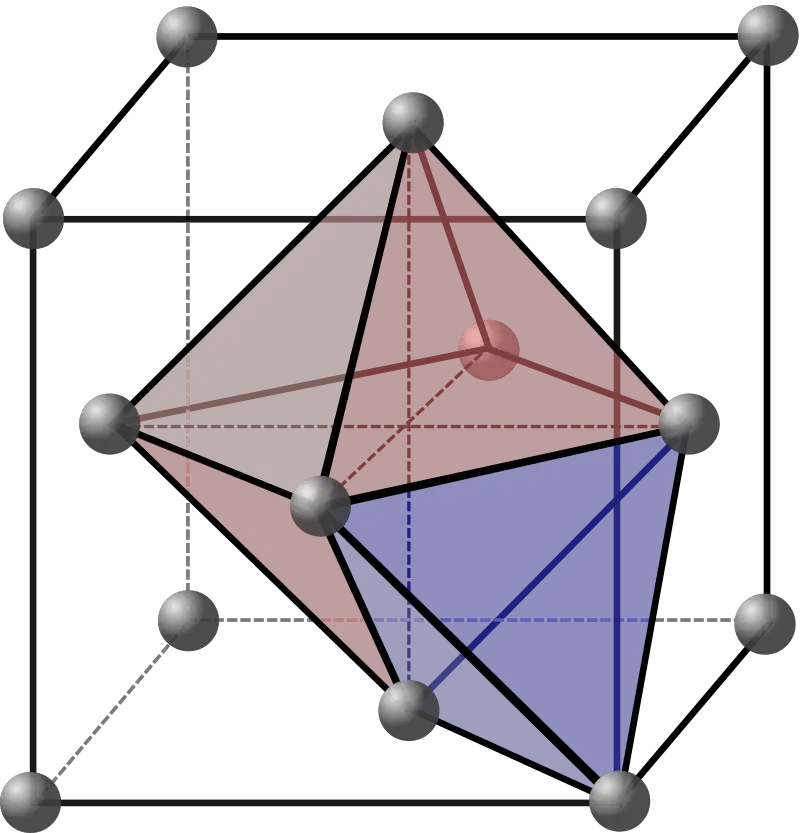
Figura 01: Red cristalina cúbica centrada en la cara con sitios de red en color azul
Lectura relacionada: Diferencia entre orto y parahidrógeno
Diferencia entre orto y parahidrógenoLos intersticiales también pueden estar presentes. Un intersticial es un átomo que ocupa una red cristalina en una posición donde no se asignan constituyentes regulares. Eso significa; Los átomos intersticiales no ocupan sitios de red. En consecuencia, estos átomos no se mezclan con los átomos de sustitución del cristal. Además, llamamos a una vacante en un enrejado un sitio de enrejado vacío. También podemos crear una vacante eliminando una partícula de un sitio de celosía. Luego, ese átomo distante recogerá un sitio de átomo cercano que es fácil de acomodar. La introducción de este tipo de puntos libres en la red cristalina aumenta la entropía del cristal.
¿Qué es un sitio intersticial?
Intersticial es una posición entre las posiciones regulares en un conjunto de partículas constituyentes que pueden ser ocupadas por otras partículas. La mayoría de los cristales tienen estructuras cúbicas compactas o hexagonales compactas. Hay sitios o "agujeros" que los átomos pueden ocupar en estas estructuras (átomos distintos de las partes constituyentes del cristal). Estos se denominan sitios intersticiales y tienen una geometría de coordinación tetraédrica u octaédrica. Los átomos que albergan estos sitios son intersticiales o intersticiales. Podemos observar un hueco octaédrico y dos huecos tetraédricos por estructura de empaque.

Figura 02: Un punto intermedio en un cristal.
Además, los átomos intersticiales pueden saltar de un sitio intersticial a otro, lo que podemos denominar difusión de sitio intersticial. Sin embargo, ningún sitio reticular regular está involucrado en este mecanismo de difusión. Esta capacidad es muy importante en la fabricación de semiconductores.
¿Cuál es la diferencia entre el sitio de celosía y el sitio intersticial?
El sitio de la red y el sitio intersticial son dos posiciones diferentes en una red cristalina. los diferencia clave entre el sitio de red y el sitio intersticial es que el sitio de red es la posición de las partículas constituyentes en la red cristalina, mientras que el sitio intersticial es una posición entre posiciones regulares en la disposición de los constituyentes del cristal que pueden ser ocupados por otras partículas.
La siguiente infografía proporciona más datos sobre la diferencia entre el sitio de cuadrícula y el sitio intermedio.

Resumen: sitio de celosía frente a sitio intersticial
El sitio de la red y el sitio intersticial son dos posiciones diferentes en una red cristalina. los diferencia clave entre el sitio de la red y el sitio intersticial es que el sitio de la red es la posición de las partículas constituyentes en la red cristalina, mientras que el sitio intersticial es una posición entre posiciones regulares en la disposición de los constituyentes del cristal que pueden ser ocupados por otras partículas.
Relación:
1. Tan, Ty "Semiconductores compuestos: difusión". Enciclopedia de Materiales: Ciencia y Tecnología2001, págs. 1425–1441., doi:10.1016/b0-08-043152-6/00263-1.
Imagen de cortesía:
1. "Enrejado de cristal cúbico centrado en la cara - (111)" Por Jcwf - Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia
2. "Sitios interstitiels cubique a face centrees" Por Christophe Dang Ngoc Chan (cdang) - Trabajo propio (CC BY-SA 3.0) a través de Commons Wikimedia