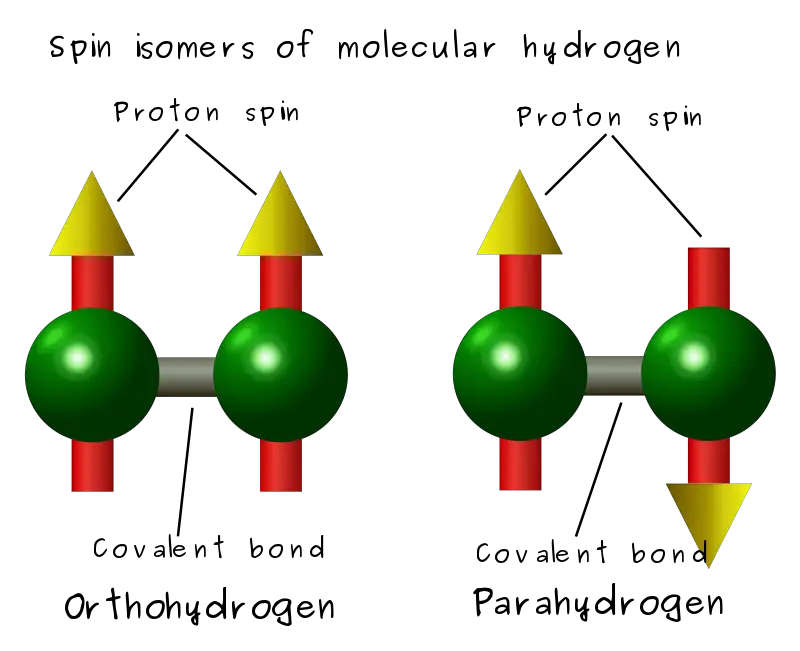
Que diferencia principal entre orto y para hidrógeno es que Las moléculas de hidrógeno orto tienen espines de dos núcleos en la misma dirección, mientras que las moléculas de hidrógeno para tienen espines de dos núcleos en direcciones opuestas.
Hidrógeno molecular en una molécula de hidrógeno (H2) se puede encontrar en dos formas como orto-hidrógeno y para-hidrógeno. Los categorizamos como tales dependiendo de la orientación de los espines nucleares de estos átomos. Por lo tanto, a menudo nos referimos a ellos como isómeros de espín.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es el ortohidrógeno?
3. ¿Qué es el parahidrógeno?
4. Comparación lado a lado - Ortho vs. Para-Hydrogen en forma tabular
5. Resumen
 Diferencia entre elementos transuránicos y radioisótopos.
Diferencia entre elementos transuránicos y radioisótopos.¿Qué es el Orto-Hidrógeno?
Las moléculas orto de hidrógeno son las moléculas de dihidrógeno que contienen átomos de hidrógeno con un espín nuclear en la misma dirección. En otras palabras, los espines de dos átomos están alineados paralelos entre sí. Es un isómero de espín de hidrógeno para.

Figura 01: Comparación de hidrógeno orto y para
Lectura relacionada: Diferencia entre parafina y nafteno.
Diferencia entre parafina y nafteno.Sin embargo, este isómero se presenta en un estado de mayor energía que el isómero parahidrógeno. Además, el ortohidrógeno forma un estado de triplete en la espectroscopia de RMN.
¿Qué es el parahidrógeno?
Las moléculas de parahidrógeno son moléculas de dihidrógeno que contienen átomos de hidrógeno con un espín nuclear en direcciones opuestas. Es decir, el espín nuclear de cada átomo en el H2 La molécula se enfrenta entre sí. Además, es un isómero de espín de orto-hidrógeno. Los átomos de espín de dos átomos de hidrógeno también están alineados en forma antiparalela. Además, este isómero se presenta en un estado de menor energía que el isómero orto. Además, este hidrógeno da un estado singlete en la espectroscopia de RMN.
¿Cuál es la diferencia entre orto y parahidrógeno?
La diferencia clave entre orto y para hidrógeno es que las moléculas de hidrógeno orto tienen giros de dos núcleos en la misma dirección, mientras que las moléculas de hidrógeno para tienen giros de dos núcleos en direcciones opuestas. Al considerar la energía de estas moléculas, el ortohidrógeno tiene un estado de energía más alto que el parahidrógeno. Además, el ortohidrógeno da el estado de triplete en la espectroscopia de RMN, mientras que el parahidrógeno da el estado de singlete.
Lectura relacionada: Diferencia entre hidrogenación e hidrogenolisis.
Diferencia entre hidrogenación e hidrogenolisis.
Resumen - Ortho vs. Para-Hidrógeno
Básicamente, orto y para hidrógeno son dos tipos de H2 Podemos clasificar las moléculas por el espín de los átomos de hidrógeno. La diferencia clave entre orto y para hidrógeno es que las moléculas de hidrógeno orto tienen giros de dos núcleos en la misma dirección, mientras que las moléculas de hidrógeno para tienen giros de dos núcleos en direcciones opuestas.
Relación:
1. "Orto y Para Hidrógeno". Química LibreTexts, Libretexts, 5 de junio de 2019, disponible aquí.
Imagen de cortesía:
1. "Isómeros de espín de hidrógeno molecular" Por GKFXtalk (Vectorizado), en: Usuario: Xaa (Jim Farris) (Original) - Vectorizado por mí mismo (GKFXtalk) de también Archivo: Spinisomers_of_molecular_hydrogen.png (CC BY-SA 3.0) a través de Commons wikimedia