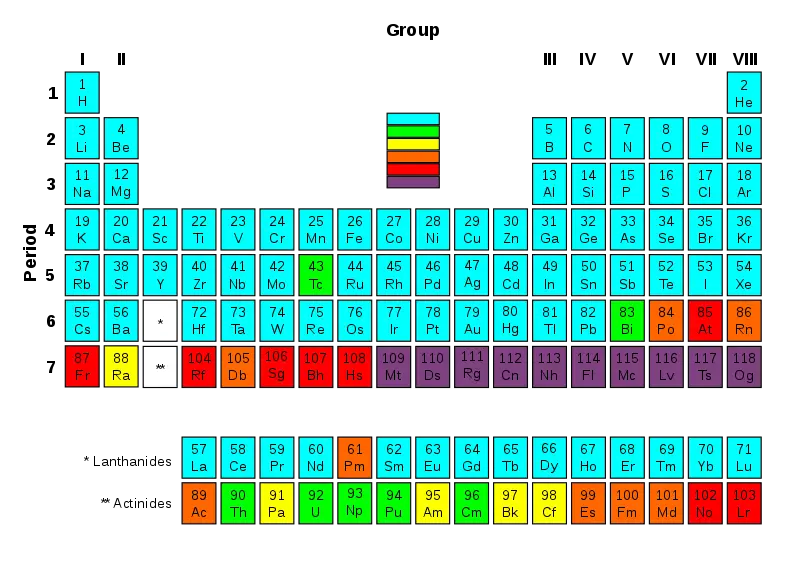
Que diferencia principal entre elementos transuránicos y radioisótopos que es Los elementos transuránicos son los elementos químicos con números atómicos superiores a 92, mientras que los radioisótopos son átomos inestables que son radiactivos.
Lectura relacionada: Diferencia entre parafina y nafteno.
Diferencia entre parafina y nafteno.Tanto los elementos transuránicos como los radioisótopos son elementos químicos radiactivos. La mayoría de las veces, los átomos radiactivos tienen un número atómico alto, pero a veces puede haber isótopos raros de algunos elementos químicos con un número atómico pequeño que son radiactivos debido a un desequilibrio de protones y neutrones en sus núcleos.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué son los elementos transuránicos?
3. ¿Qué son los radioisótopos?
4. Comparación lado a lado: elementos transuránicos frente a radioisótopos en forma tabular
5. Resumen
¿Qué son los elementos transuránicos?
Los elementos transuránicos o elementos transuránicos son elementos químicos con números atómicos superiores a 92. El número atómico del uranio es 92; de ahí que la serie de los elementos transuránicos comience con el uranio, que lleva el nombre de esta serie (trans + uranio). Todos los miembros de esta lista son radiactivos debido a su naturaleza inestable.
Lectura relacionada: Diferencia entre hidrogenación e hidrogenolisis.
Diferencia entre hidrogenación e hidrogenolisis.La mayoría de los elementos químicos de la tabla periódica tienen isótopos que podemos encontrar en el universo como átomos estables o como elementos químicos con una vida media muy larga. Estos elementos químicos van desde 1 a 92 números atómicos.

Figura 01: elementos transuránicos
Lectura relacionada: Diferencia entre la primera, segunda y tercera serie de transición
Diferencia entre la primera, segunda y tercera serie de transiciónPodemos crear elementos transuránicos usando elementos sintéticos, usando reactores nucleares o usando aceleradores de partículas. Existe una correlación entre el número atómico y la vida media de estos elementos. Las vidas medias generalmente disminuyen al aumentar el número atómico. Sin embargo, debido a algunos isótopos, puede haber algunas excepciones; por ejemplo isótopos de curio y dubnio.
Lista de elementos transuránicos
- actínidos
- neptunio
- plutonio
- americio
- curio
- berkelio
- California
- einstenio
- fermio
- Mendelevio
- nobelio
- laurencio
- elementos transactínidos
- Rutherfordio
- dubnio
- seaborgio
- Bohrio
- hassio
- meitnerio
- Darmstadter
- roentgen
- Copernicio
- nihonio
- flerovio
- Moscú
- morium hepático
- Tennesse
- Oganesson
- Elementos en el período 8 (aún no descubiertos)
¿Qué son los radioisótopos?
Los radioisótopos son isótopos radiactivos de elementos químicos. Estos isótopos son inestables porque tienen un exceso de energía nuclear. Hay tres formas en que un radioisótopo libera esta energía nuclear:
- como rayos gamma
- Liberación de un electrón de conversión
- Emisión de partículas alfa o beta
Si ocurre alguna de las tres acciones anteriores, decimos que se ha producido una desintegración radiactiva. Llamamos a estas emisiones radiación ionizante porque estos rayos emitidos pueden ionizar otro átomo para liberar un electrón.

Figura 02: El americio es un radioisótopo
Todos los elementos químicos pueden existir como átomos radiactivos en sus formas isotópicas. Por ejemplo, incluso el elemento más ligero, el hidrógeno, tiene un isótopo radiactivo: el tritio. Además, algunos elementos químicos existen solo como elementos radiactivos.
¿Cuál es la diferencia entre los elementos transuránicos y los radioisótopos?
Tanto los elementos transuránicos como los radioisótopos son elementos químicos radiactivos. los diferencia clave entre los elementos transuránicos y los radioisótopos es que los elementos transuránicos son los elementos químicos con números atómicos superiores a 92, mientras que los radioisótopos son átomos inestables que son radiactivos.
Además, los elementos transuránicos solo existen como átomos radiactivos, mientras que los radioisótopos son isótopos de elementos químicos que existen como átomos radiactivos. Por ejemplo, la serie de actínidos, la serie de transactínidos y los elementos del período 8 son elementos transuránicos. El isótopo de tritio del hidrógeno es un radioisótopo muy ligero con un número atómico muy bajo.
La siguiente infografía resume la diferencia entre los elementos transuránicos y los radioisótopos.

Resumen: elementos transuránicos frente a radioisótopos
Tanto los elementos transuránicos como los radioisótopos son elementos químicos radiactivos. los diferencia clave entre los elementos transuránicos y los radioisótopos es que los elementos transuránicos son los elementos químicos con números atómicos superiores a 92, mientras que los radioisótopos son átomos inestables que son radiactivos.
Relación:
1. Freír, Brian. "Uso de trazadores de isótopos estables". Ecología de isótopos estables, 2006, págs. 40-75., doi:10.1007/0-387-33745-8_3.
2. "Radioisótopos". OIEA, OIEA, 15 de julio de 2016, disponible aquí.
Imagen de cortesía:
1. "Radiactividad de la tabla periódica" de Periodic_Table_Armtuk3.svg: Armtuk (conferencia) trabajo derivado: Alessio Rolleri (conferencia) trabajo derivado: Gringer (conferencia) - Periodic_Table_Armtuk3.svg (CC BY-SA 3.0) a través de Commons Wikimedia
2. "Muestra de americio-241 del detector de humo" por MedicalReference - Auto fotografiado (CC BY-SA 3.0) a través de Commons Wikimedia