Que diferencia principal esto es entre la primera, segunda y tercera serie de transición el orbital d más externo de los elementos de la primera fila de transición es 3d, mientras que el orbital d más externo de la segunda fila de transición es 4d y el orbital d más externo en la tercera fila de transición es 5d.
Lectura relacionada: Diferencia entre ion carbonio y carbanion.
Diferencia entre ion carbonio y carbanion.Un metal de transición es un elemento químico con un orbital d parcialmente lleno. Hay tres series de elementos de transición en la tabla periódica de elementos; los llamamos la primera, segunda y tercera serie de transición. Estos son elementos químicos de tres períodos diferentes en la tabla periódica. Por lo tanto, contienen diferentes orbitales más externos.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la Primera Serie de Transición?
3. ¿Qué es la segunda serie de transición?
4. ¿Qué es la tercera serie de transición?
5. Comparación lado a lado: serie de transición primera, segunda y tercera en formato tabular
6. Resumen
¿Cuál es la primera serie de transición?
La primera serie de transiciones es la lista de elementos químicos que van desde el escandio hasta el cobre. También podemos referirnos a ellos como metales de transición de primera fila porque son metales contenidos en el primer período del bloque d que contiene los metales de transición. Entonces, si observa la configuración electrónica de estos elementos, todos estos elementos tienen electrones 3d y 4s. Esto significa que los orbitales d más externos de estos elementos son orbitales 3d. Además, los elementos de esta serie contienen una configuración electrónica de argón completa con electrones 3d y 4s.
Lectura relacionada: Diferencia entre reacción elemental y no elemental.
Diferencia entre reacción elemental y no elemental.
Figura 01: Tabla periódica de elementos.
Elementos químicos en la primera serie de transición.
La lista de elementos químicos de esta serie es la siguiente:
Lectura relacionada: Diferencia entre isómeros estructurales y ópticos en carbohidratos.
Diferencia entre isómeros estructurales y ópticos en carbohidratos.- escandio
- titanio
- vanadio
- cromo
- manganeso
- planchar
- cobalto
- níquel
- cobre
¿Cuál es la segunda serie de transición?
La segunda serie de transiciones es la lista de elementos químicos, que van desde el itrio hasta la plata. También podemos referirnos a ellos como metales de transición de segunda fila porque están en el segundo período del bloque d y son metales. Las configuraciones electrónicas de estos elementos tienen orbitales 4d y 5s; por lo tanto, los orbitales d más externos son orbitales 4d. Además, los elementos de esta serie contienen una configuración electrónica de criptón completa con electrones 4d y 5s. Los integrantes de esta lista son los siguientes:
Elementos químicos en la segunda serie de transición.
- itrio
- circonio
- niobio
- molibdeno
- tecnecio
- rutenio
- rodio
- paladio
- Plata
¿Qué es la tercera serie de transición?
La tercera serie de transiciones es la lista de elementos químicos, que van desde el hafnio hasta el oro y el lantano. Estos están en el tercer período del bloque d y también contienen el primer miembro de la serie de los lantánidos (lantano) ya que los elementos de la tercera serie de transición y el lantano tienen orbitales electrónicos 5d y 6s en su configuración electrónica. Además, los elementos de esta serie contienen una configuración electrónica completa de xenón con electrones 5d y 6s.

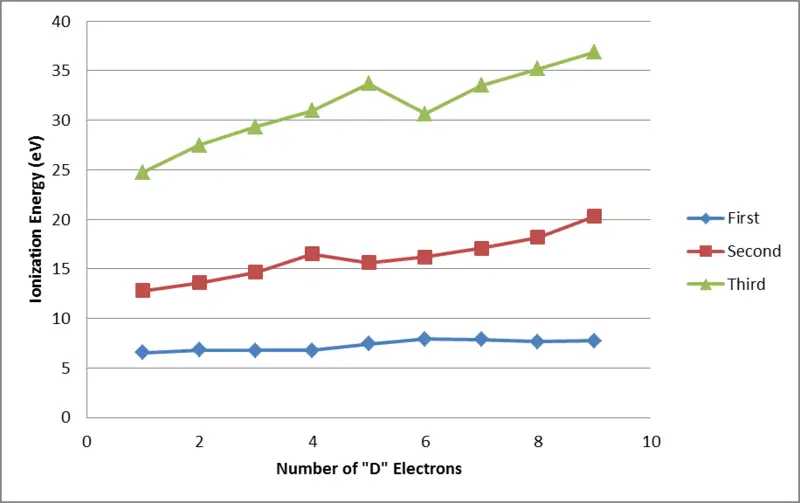
Figura 02: Energías de ionización de los elementos de transición primero, segundo y tercero
Elementos químicos de la tercera serie de transición.
- lantano
- hafnio
- tantalio
- tungsteno
- renio
- osmio
- indio
- platino
- oro
¿Cuál es la diferencia entre la primera, segunda y tercera serie de transición?
En la tabla periódica de los elementos hay tres series de elementos de transición, a los que nos referimos como primera, segunda y tercera serie de transición. La principal diferencia entre la primera, la segunda y la tercera fila de transición es que el orbital d más externo de los elementos de la primera fila de transición es 3d, mientras que el orbital d más externo de la segunda fila de transición es 4d y el orbital d más externo de la tercera fila de transición es 5d.
Además, la primera serie de transición es la lista de elementos químicos que van desde el escandio hasta el cobre. La segunda serie de transición es la lista de elementos químicos desde el itrio hasta la plata, mientras que la tercera serie de transición es la lista de elementos químicos desde el hafnio hasta el oro más el lantano. Entre estas tres series, la segunda y la tercera serie de transición tienen propiedades estrechamente relacionadas que difieren significativamente de las propiedades de la primera serie de transición.
Además, los elementos de la primera fila de transición contienen una configuración electrónica de argón completa con electrones 3d y 4s. Sin embargo, la segunda fila de transición contiene una configuración electrónica de criptón completa con electrones 4d y 5s. Mientras tanto, los elementos de la tercera fila de transición contienen una configuración electrónica de xenón completa con electrones 5d y 6s. Entonces, esta también es una diferencia significativa entre la primera, la segunda y la tercera serie de transición.

Resumen: primera, segunda, tercera serie de transición
Hay tres series de elementos de transición en la tabla periódica de elementos; los llamamos la primera, segunda y tercera serie de transición. La principal diferencia entre la primera, la segunda y la tercera fila de transición es que el orbital d más externo de los elementos de la primera fila de transición es 3d, mientras que el orbital d más externo de la segunda fila de transición es 4d y el orbital d más externo de la tercera fila de transición es 5d.
Relación:
1. "23.1: Propiedades generales de los metales de transición". Química LibreTexts, Libretexts, 18 de septiembre de 2019, disponible aquí.
2. "Tercera Serie de Transición (o) Serie 5d." Simplemente ciencia, disponible aquí.
Imagen de cortesía:
1. "Energías de ionización de metales de transición" por Oncandor - Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia
2. "Gráfico de tabla periódica simple-en" por Offnfopt - Trabajo propio (Dominio público) a través de Commons Wikimedia