
Diferencia principal - Ksp contra Qsp
Ksp es la constante del producto de solubilidad y Qsp es el cociente del producto de solubilidad. Que diferencia principal entre Ksp y Qsp es que Ksp indica la solubilidad de una sustancia, mientras que Qsp indica el estado actual de una solución. El producto de solubilidad es el producto de las concentraciones de especies iónicas presentes en una solución cuando una sustancia se disuelve en un solvente como el agua.
Lectura relacionada: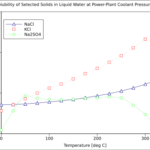 Diferencia entre producto iónico y producto de solubilidad.
Diferencia entre producto iónico y producto de solubilidad.El producto de solubilidad se determina cuando la solución está saturada con esa sustancia. La relación del producto de solubilidad es el producto de las concentraciones de especies iónicas en una solución en cada momento; antes de la saturación o después de que la solución esté saturada. A veces se lo denomina producto iónico.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es Ksp?
3. ¿Qué es Qsp?
4. Relación entre Ksp y Qsp
5. Comparación lado a lado: Ksp frente a Qsp en forma tabular
6. Resumen
¿Qué es KSP?
Ksp es la constante del producto de solubilidad de una sustancia dada. Indica la solubilidad de una sustancia (cuánto sólido se disuelve en una solución). La constante del producto de solubilidad se da para una solución que está saturada con una sustancia. Cuanto mayor sea la Ksp, mayor será la solubilidad de esta sustancia. El producto de solubilidad se da como el producto de las concentraciones de especies iónicas en una solución.
Lectura relacionada: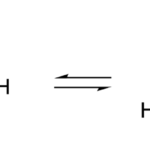 Diferencia entre la constante de ionización ácida y la constante de ionización básica
Diferencia entre la constante de ionización ácida y la constante de ionización básicaAparece una solución saturada con turbidez, lo que indica el comienzo de la formación de precipitaciones. Es la forma insoluble del soluto. La porción líquida de este sistema contiene los solutos solubles. La Ksp de esta solución representa el equilibrio entre estas formas solubles e insolubles.
Los factores que afectan el valor de la constante del producto de solubilidad son la temperatura, la presencia de iones comunes, el pH o la acidez, etc. A medida que aumenta la temperatura, también aumenta la solubilidad del precipitado sólido. Luego, el producto de las concentraciones de especies iónicas aumenta, lo que conduce a un alto valor de la constante del producto de solubilidad. La presencia de un ion común se describe mediante el efecto del ion común. Cuando un ion común está presente, Ksp se reduce. Un ion común significa una de las especies de iones ya presentes en esa solución. Por ejemplo, para un sistema en equilibrio que contiene BaSO4 (sulfato de bario), coprecipita con Ba+2 iones y SO42- iones, la adición de Ba+2 más o menos42- Los iones pueden afectar el equilibrio.
BaSO4(s)↔ Ba+2(ac) + SO42-(ac)
Lectura relacionada: Diferencia entre catalizador homogéneo y heterogéneo.
Diferencia entre catalizador homogéneo y heterogéneo.
Figura 01: Ksp de una solución saturada con BaSO4
Cuando uno de estos iones se agrega desde una fuente externa, el equilibrio anterior se desplaza hacia la izquierda (se forma una forma más insoluble de la sustancia, lo que reduce la cantidad de iones presentes en la solución), lo que reduce la solubilidad de esa sustancia.
¿Qué es QSP?
Qsp es el cociente del producto de solubilidad de una solución. Describe el estado actual de una solución. Entonces, Qsp se da para una solución no saturada (antes de la saturación), saturada o sobresaturada. El Qsp también se denomina producto iónico porque es el producto de las concentraciones de especies iónicas en cualquier momento (no en un momento específico como la saturación). Por lo tanto, Ksp (la constante del producto de solubilidad) es una forma especial de Qsp.
¿Cuál es la relación entre Ksp y Qsp?
- Si el Qsp de una sustancia en una solución es menor que el Ksp, se pueden disolver más sólidos en esa solución.
- Si Qsp y Ksp tienen los mismos valores, entonces la solución está saturada.
- Si Qsp es mayor que el valor de Ksp, se forma un precipitado.
¿Cuál es la diferencia entre Ksp y Qsp?
Ksp frente a Qsp |
|
| Ksp es la constante del producto de solubilidad de una sustancia dada. | Qsp es el cociente del producto de solubilidad de una solución. |
| Naturaleza | |
| Ksp es un valor de equilibrio. | Qsp no es un valor de equilibrio. |
| estado de la solucion | |
| Ksp es el producto de las concentraciones de especies iónicas en una solución saturada. | Qsp es el producto de las concentraciones de especies iónicas en una solución insaturada, saturada o sobresaturada. |
Resumen - Ksp contra Qsp
Ksp y Qsp son términos muy relacionados en química. Ksp se define como una solución saturada que está en equilibrio entre especies iónicas y un precipitado sólido (el momento en que se ha comenzado a formar un precipitado). Qsp se da (sin especificar) para cada momento; antes de la saturación o después de la saturación. La diferencia entre Ksp y Qsp es que Ksp es la constante del producto de solubilidad mientras que Qsp es el cociente del producto de solubilidad.











