Que diferencia principal entre la ley de las proporciones definidas y la ley de las proporciones múltiples es que tLa ley de las proporciones definidas establece que las muestras de un compuesto siempre contienen la misma fracción de masa de elementos. Por el contrario, la ley de las proporciones múltiples (a veces denominada ley de Dalton) establece que cuando dos elementos se combinan para formar más de un compuesto químico, las proporciones de las masas del segundo elemento se combinan con una masa fija del primer elemento, las proporciones de los números enteros pequeños siguen siendo las mismas.
Lectura relacionada: Diferencia entre hielo seco y nitrógeno líquido.
Diferencia entre hielo seco y nitrógeno líquido.La ley de las proporciones definidas y la ley de las proporciones múltiples son teorías utilizadas para explicar la estequiometría en química. La estequiometría es la medida de las cantidades relativas de reactivos y productos en una reacción química.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la ley de las proporciones definidas?
3. ¿Qué es la ley de las proporciones múltiples?
4. Comparación lado a lado: ley de proporciones definidas versus ley de proporciones múltiples en forma tabular
5. Resumen
¿Qué es la ley de las proporciones definidas?
La ley de las proporciones definidas establece que las muestras de un compuesto siempre contienen la misma fracción de masa de elementos. En otras palabras, un compuesto dado siempre contiene los mismos elementos en las mismas fracciones de masa.
Lectura relacionada: Diferencia entre carbonato de calcio y bicarbonato de calcio
Diferencia entre carbonato de calcio y bicarbonato de calcioPor ejemplo, ya sea agua del grifo o agua de mar, una molécula de agua siempre contiene elementos de hidrógeno y oxígeno en las siguientes proporciones.
La fórmula química de la molécula de agua = H2O
Masa molar de la molécula de agua = 18 g/mol
Lectura relacionada: Diferencia entre metales pesados y oligoelementos
Diferencia entre metales pesados y oligoelementosAsí, un mol de agua contiene 18 g H2O. La relación entre H y O en la molécula de agua es 2:1. Por lo tanto, la fracción de masa de hidrógeno en agua = (2g/18g) x 100% = 11,11% y la fracción de masa de oxígeno = (16g/18g) x 100% = 88,89%. Estas fracciones son únicas y no cambian según la fuente del agua y el método de separación.

Figura 01: La ley de las proporciones definidas establece que en un determinado tipo de sustancia química, los elementos siempre se combinan en proporciones iguales en masa.
Esta ley se basa en el hecho de que todos los átomos de un mismo elemento (átomos con el mismo número atómico) son similares entre sí. Para el ejemplo anterior se consideró que cada átomo de hidrógeno es similar al de otro átomo de hidrógeno y viceversa. Pero también hay algunas excepciones. Por ejemplo, la composición isotópica de un elemento puede variar según la fuente. Por lo tanto, la estequiometría muestra variaciones según la fuente de los elementos.
¿Qué es la ley de las proporciones múltiples?
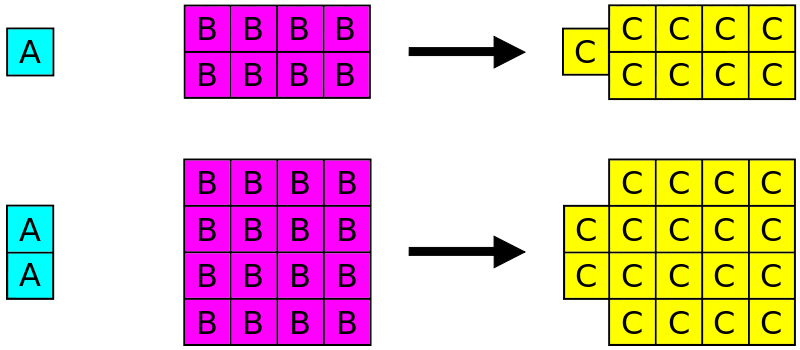
La ley de las proporciones múltiples establece que cuando dos elementos se combinan para formar más de un compuesto, entonces los pesos de un elemento que se combinan con un peso fijo del otro están en una proporción de número entero pequeño.

Figura 02: Una explicación de la ley de las proporciones múltiples
Esto a veces se llama ley de dalton. Eso fue después de que John Dalton descubriera esta ley en 1803. Entendamos esta ley con un ejemplo.
- Los óxidos de nitrógeno consisten en átomos de nitrógeno y oxígeno. Hay cinco óxidos de nitrógeno diferentes; norte2O, NO, N2O3NO2 y N2O5. Si observa las proporciones de masa de N y O en estos compuestos, según la proporción de masa, 14 gramos de átomo de nitrógeno se combinan con 8, 16, 24, 32 y 40 gramos de oxígeno. Tomados como pequeños números enteros, las proporciones son 1:1, 1:2, 1:3, 1:4 y 1:5.
¿Diferencia entre la ley de las proporciones definidas y la ley de las proporciones múltiples?
La ley de las proporciones definidas establece que las muestras de un compuesto siempre contienen la misma fracción de masa de elementos. Por otro lado, la ley de las proporciones múltiples enfatiza que cuando dos elementos se combinan para formar más de un compuesto, los pesos de un elemento que se combinan con un peso fijo del otro están en una pequeña proporción de enteros. Esta es la principal diferencia entre la ley de las proporciones definidas y la ley de las proporciones múltiples.

Resumen - Ley de proporciones definidas vs. Ley de proporciones múltiples
La ley de las proporciones definidas y la ley de las proporciones múltiples se utilizan para explicar la estequiometría de los compuestos en las reacciones químicas. La ley de las proporciones definidas establece que las muestras de un compuesto siempre contienen la misma fracción de masa de elementos. Por el contrario, la ley de las proporciones múltiples establece que cuando dos elementos se combinan para formar más de un compuesto químico, las proporciones de las masas del segundo elemento que se combinan con una masa fija del primer elemento son proporciones de números enteros pequeños. Por lo tanto, esta es la diferencia entre la ley de las proporciones definidas y la ley de las proporciones múltiples.
Relación:
1. Helmenstina, Anne Marie, Ph.D. "Definición de la ley de proporciones definidas". ThoughtCo 14 de noviembre de 2017. Disponible aquí
2. Los editores de la Encyclopædia Britannica. "Ley de ciertas proporciones." Encyclopædia Britannica, Encyclopædia Britannica, Inc., 3 de febrero de 2017. Disponible aquí
3. “estequiometría”. Wikipedia, Fundación Wikimedia, 25 de febrero de 2018. Disponible aquí
Imagen de cortesía:
1. 'Ley de proporciones definidas' Por CK-12 Foundation (raster), Adrignola (vector) - Archivo: High School Chemistry.pdf, página 141, (Dominio público) a través de Commons Wikimedia
2. "Demostración de la ley de las proporciones múltiples" por Kenji Agari - Trabajo propio, (CC BY-SA 3.0) a través de Commons Wikimedia