Que diferencia principal entre sal ácida y sal básica Las sales ácidas forman una solución con un pH inferior a 7,0 cuando se disuelven en agua, mientras que las sales básicas forman una solución con un pH superior a 7,0 cuando se disuelven en agua.
Lectura relacionada: Diferencia entre isomerización e hidroisomerización.
Diferencia entre isomerización e hidroisomerización.Una sal es un compuesto iónico que contiene un catión y un anión. Es un compuesto sólido que no tiene carga neta porque los cationes y los aniones se combinan de tal manera que la carga eléctrica de los cationes se equilibra con la de los aniones. Dependiendo de la composición iónica de una sal, se pueden determinar sus propiedades y reactividad. Por lo tanto, podemos dividir una sal en tres grupos: sales ácidas, sales básicas y sales neutras.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es una sal ácida?
3. ¿Qué es una sal básica?
4. Comparación lado a lado: sal ácida frente a sal básica en forma tabular
5. Resumen
¿Qué es una sal ácida?
Las sales ácidas son compuestos iónicos que pueden formar soluciones ácidas cuando se disuelven en agua. Eso significa; la sal ácida forma una solución acuosa con un pH inferior a 7,0. Esto ocurre ya sea por la presencia de un catión metálico que puede reaccionar como un ácido de Lewis o por la presencia de protones hidrolizables. Más comúnmente, las sales ácidas contienen protones hidrolizables. Estos protones hidrolizables pueden estar presentes tanto en el catión como en el anión.
Lectura relacionada: Diferencia entre reactivos catalíticos y estequiométricos.
Diferencia entre reactivos catalíticos y estequiométricos.
Figura 01: el bisulfito de sodio es una sal ácida
Protones hidrolizables en el catión
Las sales de ácido que contienen cationes con protones hidrolizables son principalmente iones de amonio. Los iones de amonio provienen de las sales de amonio. Además, estos protones hidrolizables se pueden encontrar en compuestos orgánicos que contienen grupos amino protonados. B. iones de amonio, iones de metilamonio, iones de etilamonio, iones de anilinio, etc.
Lectura relacionada: Diferencia entre orto para y meta sustitución
Diferencia entre orto para y meta sustituciónProtones hidrolizables en el anión
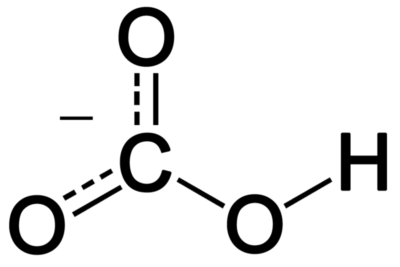
Las sales ácidas pueden contener los protones hidrolizables en el anión. Los ejemplos incluyen iones de bisulfito, citrato de dihidrógeno, iones de bioxalato, etc. Estos aniones contienen protones que se disocian débilmente en agua.
¿Qué es una sal básica?
Las sales básicas son compuestos iónicos que pueden formar soluciones básicas cuando se disuelven en agua. Eso significa; estas sales pueden formar una solución acuosa con un pH superior a 7,0. En general, una sal básica puede desprotonar una molécula de agua y formar iones de hidróxido, lo que puede causar basicidad en la solución acuosa.

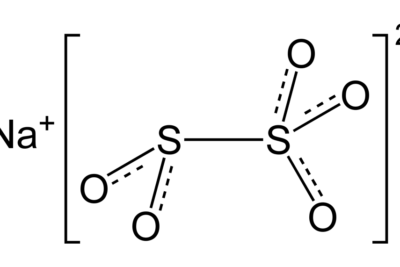
Figura 02: El sulfuro de sodio es una sal básica.
Algunos ejemplos de sales básicas incluyen bicarbonato de sodio, carbonato de calcio, acetato de sodio, cianuro de potasio y sulfuro de sodio. Estas sales pueden reaccionar con el agua y obligar a las moléculas de agua a eliminar un ion de hidróxido.
¿Cuál es la diferencia entre la sal ácida y la sal básica?
La diferencia clave entre la sal ácida y la sal básica es que las sales ácidas forman una solución con un pH inferior a 7,0 cuando se disuelven en agua, mientras que las sales básicas forman una solución con un pH superior a 7,0 cuando se disuelven en agua forman 7,0. Las sales de amonio, el bisulfito de sodio y el oxalato de calcio son algunos ejemplos de sales ácidas, mientras que el bicarbonato de sodio, el carbonato de calcio, el acetato de sodio, el cianuro de potasio y el sulfuro de sodio son algunos ejemplos de sales básicas.
La siguiente infografía resume la diferencia entre la sal ácida y la sal básica.

Resumen: sal ácida frente a sal básica
Dependiendo de la composición iónica de una sal, se pueden determinar sus propiedades y reactividad. Por lo tanto, podemos dividir una sal en tres grupos: sales ácidas, sales básicas y sales neutras. La diferencia clave entre la sal ácida y la sal básica es que las sales ácidas forman una solución con un pH inferior a 7,0 cuando se disuelven en agua, mientras que las sales básicas forman una solución con un pH superior a 7,0 cuando se disuelven en agua forman 7,0.
Relación:
1. "Propiedades ácido-base de las sales". Boundless Chemistry” Lumen, disponible aquí.
2. "7.8: Propiedades ácido-base de las sales". Química LibreTexts, Libretexts, 3 de junio de 2019, disponible aquí.
3. "Sal ácida". Wikipedia, Fundación Wikimedia, 17 de octubre de 2019, disponible aquí.
Imagen de cortesía:
1. "Bisulfato de sodio" por Edgar181 - Trabajo propio, dominio público) a través de Commons Wikimedia
2. "Cristales de nonahidrato de sulfuro de sodio" por Leiem - Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia