Diferencia clave: VBT frente a CFT
El término VBT significa Teoría del enlace de valencia. Es una teoría utilizada para describir la formación de varios enlaces químicos entre átomos. Esta teoría explica la superposición o mezcla de orbitales atómicos para formar enlaces químicos. El término CFT significa teoría del campo cristalino. Es un modelo destinado a explicar la ruptura de la degeneración (capas de electrones de igual energía) de los orbitales de electrones (generalmente orbitales d o f) debido al campo eléctrico estático creado por uno o más aniones (o ligandos) circundantes. La principal diferencia entre VBT y CFT es esta VBT explica el barajado orbital mientras que CFT explica la división orbital.
Lectura relacionada: Diferencia entre Tris base y Tris HCl
Diferencia entre Tris base y Tris HClCONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es VBT?
3. ¿Qué es CFT?
4. Comparación lado a lado - VBT vs. CFT en forma tabular
5. Resumen
¿Qué es VBT?
El término VBT significa Teoría del enlace de valencia. Explica el enlace químico de un compuesto covalente. Por lo tanto, VBT explica cómo se forma un enlace covalente. Un enlace covalente se forma al compartir electrones entre átomos. Los átomos comparten electrones para llenar su configuración electrónica (de lo contrario, son inestables). Los electrones se comparten mezclando o superponiendo orbitales atómicos. Sin embargo, antes de que haya superposición, se deben cumplir varios requisitos.
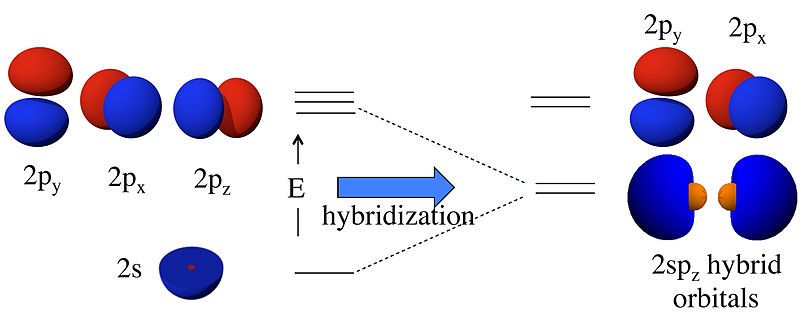
Hay dos tipos de enlaces covalentes como enlaces sigma y enlaces pi. Estos enlaces se forman por superposición de orbitales atómicos. La superposición de los orbitales s siempre forma enlaces sigma. La superposición de los orbitales p provoca la formación de enlaces pi. La superposición de los orbitales atómicos s y p provoca la formación de orbitales híbridos; Por lo tanto, el proceso se llama hibridación.
Lectura relacionada: Diferencia entre agua hidrogenada y agua alcalina.
Diferencia entre agua hidrogenada y agua alcalina.
Figura 01: Hibridación de orbitales 2s y 2p
Hay tres orbitales híbridos principales que se pueden formar:
Lectura relacionada: Diferencia entre hidrógeno atómico e hidrógeno naciente
Diferencia entre hidrógeno atómico e hidrógeno naciente- Orbital híbrido sp - Formado por la hibridación de un orbital s y un orbital p.
- Orbital híbrido sp2: formado por la hibridación de un orbital s y dos p.
- Orbital híbrido sp3: formado por la hibridación de un orbital s y tres p.
¿Qué es CFT?
El término CFT significa teoría del campo cristalino. La teoría del campo cristalino es un modelo desarrollado para explicar la ruptura de la degeneración (capas de electrones de igual energía) de los orbitales de electrones (generalmente orbitales d o f) debido al campo eléctrico estático creado por uno o más aniones (o ligandos) circundantes. La teoría del campo cristalino se usa a menudo para demostrar el comportamiento de los complejos de iones de metales de transición. Esta teoría también puede explicar propiedades magnéticas, colores de complejos de coordinación, entalpías de hidratación, etc.
teoría
La interacción ión metálico-ligando se debe a la fuerza de atracción entre el ión metálico cargado positivamente y los electrones desapareados (carga negativa) del ligando. Esta teoría se basa principalmente en los cambios que ocurren en cinco orbitales electrónicos d degenerados (un átomo de metal tiene cinco orbitales d). Cuando un ligando se acerca al ion metálico, los electrones desapareados están más cerca de algunos orbitales d en comparación con otros orbitales d del ion metálico. Esto provoca una pérdida de degeneración. Los electrones en los orbitales d repelen los electrones del ligando (ambos tienen carga negativa). Por lo tanto, los orbitales d más cercanos al ligando tienen mayor energía que otros orbitales d. Esto conduce a la división de los orbitales d en orbitales d de alta energía y orbitales d de baja energía en función de la energía.
Algunos factores que afectan esta división incluyen la naturaleza del ion metálico, el estado de oxidación del ion metálico, la disposición de los ligandos alrededor del ion metálico central y la naturaleza de los ligandos. Después de la división energética de estos orbitales d, la diferencia entre los orbitales d de alta y baja energía se da como un parámetro de división lleno de cristal (∆Oct para complejos octaédricos).

Figura 02: patrón de división en complejos octaédricos
patrón dividido
Dado que hay cinco orbitales d, la división se produce en una proporción de 2:3. En los complejos octaédricos hay dos orbitales en el nivel de alta energía (denominados colectivamente eg) y tres orbitales en el nivel de energía más bajo (denominados colectivamente t2g). En los complejos tetraédricos ocurre lo contrario; tres orbitales están en el nivel de energía más alto y dos están en el nivel de energía más bajo.
¿Cuál es la diferencia entre VBT y CFT?
VBT frente a CFT |
|
| El término VBT significa Teoría del enlace de valencia. | El término CFT significa teoría del campo cristalino. |
| teoría | |
| VBT es una teoría que explica la formación de un enlace covalente a través de la hibridación de orbitales atómicos. | CFT es un modelo desarrollado para explicar la ruptura de la degeneración orbital de electrones debido a un campo eléctrico estático creado por un anión o aniones circundantes. |
| explicación | |
| VBT explica el barajado orbital. | CFT explica la división de orbitales. |
Resumen: VBT frente a CFT
El término VBT significa Teoría del enlace de valencia. El término CFT significa teoría del campo cristalino. La principal diferencia entre VBT y CFT es que VBT explica la mezcla orbital, mientras que CFT explica la división orbital.
Relación:
1. "Teoría del campo cristalino". Wikipedia, Fundación Wikimedia, 18 de febrero de 2018, disponible aquí.
2. "Teoría del enlace de valencia". Química LibreTexts, Libretexts, 24 de enero de 2018, disponible aquí.
Imagen de cortesía:
1. "Hibridación sp" por Tem5psu - Trabajo propio (CC BY-SA 3.0) a través de Commons Wikimedia
2. "División del campo de cristal octaédrico" por el usuario de Wikipedia en inglés YanA (CC BY-SA 3.0) a través de Commons Wikimedia