El peso atómico y la masa atómica son dos conceptos importantes en química y física, a menudo confundidos por aquellos que no distinguen entre "número atómico y peso atómico". Muchas personas usan los términos indistintamente, pero en realidad no significan lo mismo. Eche un vistazo a la diferencia entre el peso atómico y la masa atómica, y comprenda por qué la mayoría de las personas están confundidas o no les importa la distinción. (Si estás tomando una clase de química, la distinción entre número atómico y peso atómico podría aparecer en un examen, ¡así que presta atención!)
Masa Atómica Versus Peso Atómico
El uranio tiene dos isótopos primordiales (uranio-238 y uranio-235). El uranio-238 tiene 92 protones más 146 neutrones y el uranio-235 92 protones y 143 neutrones.
Pallava Bagla/Getty Images
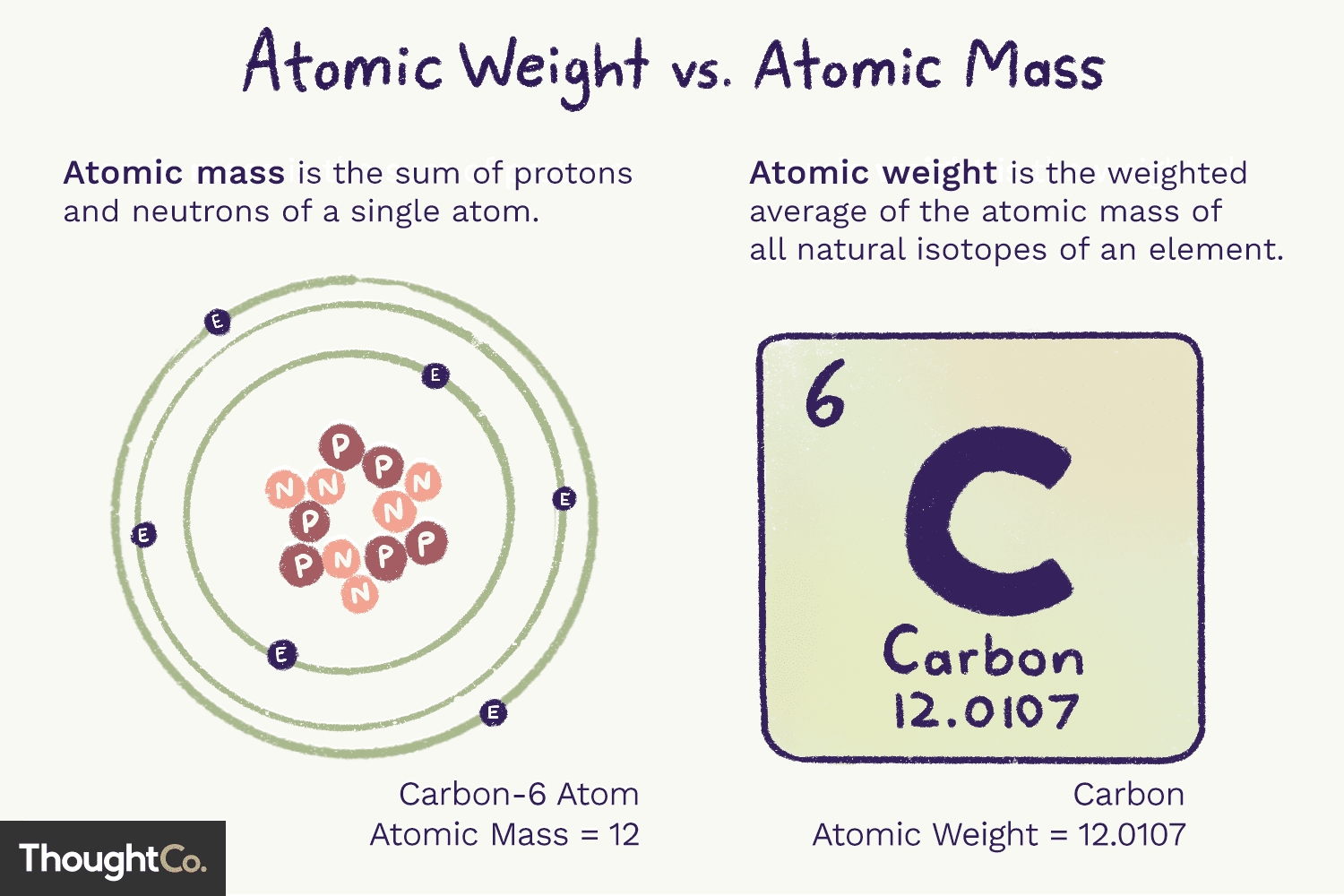
Masa atómica (ma) es la masa de un átomo. Un solo átomo tiene un número determinado de protones y neutrones, por lo que la masa es inequívoca (no cambiará) y es la suma del número de protones y neutrones en el átomo. Los electrones aportan tan poca masa que no se cuentan.
Lectura relacionada: Definición y Ejemplos en Química
Definición y Ejemplos en Química
El peso atómico es un promedio ponderado de la masa de todos los átomos de un elemento, basado en la abundancia de isótopos. El número atómico y peso atómico de un elemento pueden variar debido a esta naturaleza isótópica. El peso atómico puede cambiar porque depende de nuestra comprensión de la cantidad de cada isótopo de un elemento que existe.
Tanto la masa atómica como el peso atómico se basan en la unidad de masa atómica (uma), que es 1/12 de la masa de un átomo de carbono-12 en su estado fundamental.
Lectura relacionada:
 10 Mezclas Heterogéneas y Homogéneas
10 Mezclas Heterogéneas y Homogéneas¿Pueden la Masa Atómica y el Peso Atómico Ser Iguales?
Si encuentra un elemento que existe como un solo isótopo, entonces la masa atómica y el peso atómico serán los mismos. La masa atómica y el peso atómico también pueden ser iguales cuando se trabaja con un solo isótopo de un elemento. En este caso, se utiliza la masa atómica en los cálculos en lugar del peso atómico del elemento de la tabla periódica.
La masa es una medida de la cantidad de una sustancia, mientras que el peso es una medida de cómo actúa una masa en un campo gravitatorio. En la Tierra, donde estamos expuestos a una aceleración bastante constante debido a la gravedad, no prestamos mucha atención a la diferencia entre los términos. Después de todo, nuestras definiciones de masa se hicieron más o menos teniendo en cuenta la gravedad de la Tierra, por lo que si dices que un peso tiene una masa de 1 kilogramo y un peso de 1 de 1 kilogramo, tienes razón. Ahora, si llevas esa masa de 1 kg a la Luna, su peso será menor.
Lectura relacionada: Cómo Se Producen Los Colores De Prueba De Llama
Cómo Se Producen Los Colores De Prueba De Llama
Entonces, cuando se acuñó el término peso atómico en 1808, los isótopos eran desconocidos y la gravedad de la Tierra era la norma. La diferencia entre el peso atómico y la masa atómica se conoció cuando F. W. Aston, el inventor del espectrómetro de masas (1927) utilizó su nuevo dispositivo para estudiar el neón. En ese momento, se creía que el peso atómico del neón era de 20,2 uma, pero Aston observó dos picos en el espectro de masas del neón, a masas relativas de 20,0 uma y 22,0 uma. Aston sugirió que en realidad hay dos tipos de átomos de neón en su muestra: el 90% de los átomos tienen una masa de 20 amu y el 10% con una masa de 22 amu. Esta relación dio una masa media ponderada de 20,2 uma. Llamó a las diferentes formas de los átomos de neón "isótopos". Frederick Soddy había propuesto el término isótopos en 1911 para describir átomos que ocupan la misma posición en la tabla periódica, pero que son diferentes.
A pesar de que "peso atómico" no es una buena descripción, la frase se ha mantenido por razones históricas. El término correcto hoy en día es "masa atómica relativa—: la única parte de "peso" del peso atómico es que se basa en un promedio ponderado de la abundancia de isótopos.