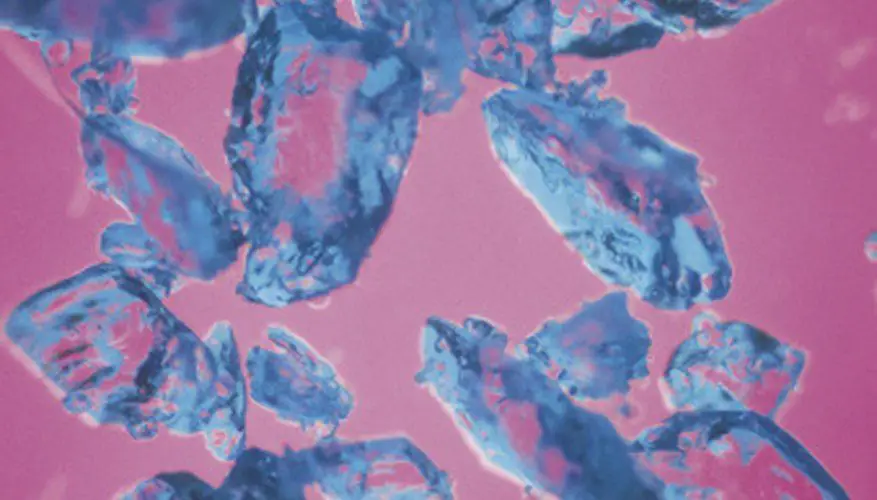
Al igual que muchos complejos de metales de transición, el sulfato de cobre (II) pentahidratado es de colores brillantes; los cristales de esta hermosa sustancia son de un tono pálido de azul. Su color proviene de la química y la física de su composición, o, más específicamente, del tipo de enlaces que forma con los iones sulfato y las moléculas de agua unidas al cobre.
Orbitales
Los electrones exhiben dualidad onda-partícula, lo que significa que tienen propiedades similares a ondas y propiedades similares a partículas. El comportamiento de un electrón en un átomo se describe mediante una ecuación ondulatoria llamada función de onda. El cuadrado de la función de onda da la probabilidad de que el electrón se encuentre en cualquier punto particular en cualquier momento dado. Las funciones de onda de los electrones en los átomos también se denominan orbitales atómicos. Los químicos nombran los orbitales atómicos usando un número para designar el nivel de energía del orbital seguido de una letra para designar el tipo de orbital. Para los elementos en el cuarto período de la tabla periódica o superior, solo necesita enfocarse en tres tipos de orbitales, a saber, s, p y d. Para tener una idea de la forma de estos orbitales, consulte el enlace en la sección de recursos.
División del Campo Cristalino
El ion cobre en el sulfato de cobre (II) ha perdido dos electrones, por lo que tiene una carga +2. Tiene nueve electrones en su nivel de energía más externo o capa; estos llamados electrones de valencia ocupan orbitales 3d. Las moléculas de agua y los iones sulfato son atraídos por la carga positiva del ion cobre, por lo que se acercan a él y se disponen a su alrededor en una configuración octaédrica. En consecuencia, dos de los cinco orbitales 3d del ion de cobre se alinean a lo largo de los ejes por los cuales se acercan los iones sulfato y las moléculas de agua; dado que los electrones en estos orbitales y los electrones en las moléculas/iones tienen carga negativa, se repelen entre sí. En última instancia, entonces, dos de los cinco orbitales 3d tienen mayor energía; estos se llaman orbitales eg. Los otros tres, por el contrario, tienen una energía disminuida y se denominan orbitales t2g.
Lectura relacionada: ¿Qué Minerales Hay en una Bombilla?
¿Qué Minerales Hay en una Bombilla?Absorción de Luz
Un fotón de luz será absorbido por el complejo de coordinación si tiene una energía equivalente a la diferencia entre el estado que ocupa ahora un electrón y la energía de otro estado disponible para él. En consecuencia, el complejo de sulfato de cobre puede absorber fotones de luz con energías equivalentes a la diferencia de energía entre los orbitales t2g y eg. Como sucede, la diferencia de energía para el complejo de sulfato de cobre es equivalente a la diferencia de energía para los fotones de luz en la región rojo-naranja del espectro. Dado que la luz rojiza se absorbe mientras que la luz azul se transmite, el sulfato de cobre aparece azul.
Disolución en Agua
Cuando el sulfato de cobre se disuelve en agua, los iones de cobre y sulfato se disocian. Ahora el ion de cobre forma un complejo octaédrico donde está rodeado por seis moléculas de agua. Sin embargo, el efecto sigue siendo muy similar, porque la división entre los orbitales t2g y los orbitales eg en este nuevo complejo sigue siendo tal que la luz naranja rojiza se absorbe y se ve una solución de color azul.
 Qué es un Compuesto Orgánico?
Qué es un Compuesto Orgánico?