Las proteínas son polímeros biológicos compuestos de aminoácidos. Los aminoácidos, unidos entre sí por enlaces peptídicos, forman una cadena polipeptídica. Una o más cadenas polipeptídicas retorcidas en forma de 3-D forman una proteína. Las proteínas tienen formas complejas que incluyen varios pliegues, bucles y curvas. El plegamiento de las proteínas ocurre espontáneamente. La unión química entre porciones de la cadena polipeptídica ayuda a mantener unida la proteína y darle su forma. Hay dos clases generales de moléculas de proteína: proteínas globulares y proteínas fibrosas. Las proteínas globulares son generalmente compactas, solubles y de forma esférica. Las proteínas fibrosas son típicamente alargadas e insolubles. Las proteínas globulares y fibrosas pueden exhibir uno o más de cuatro tipos de estructura proteica.
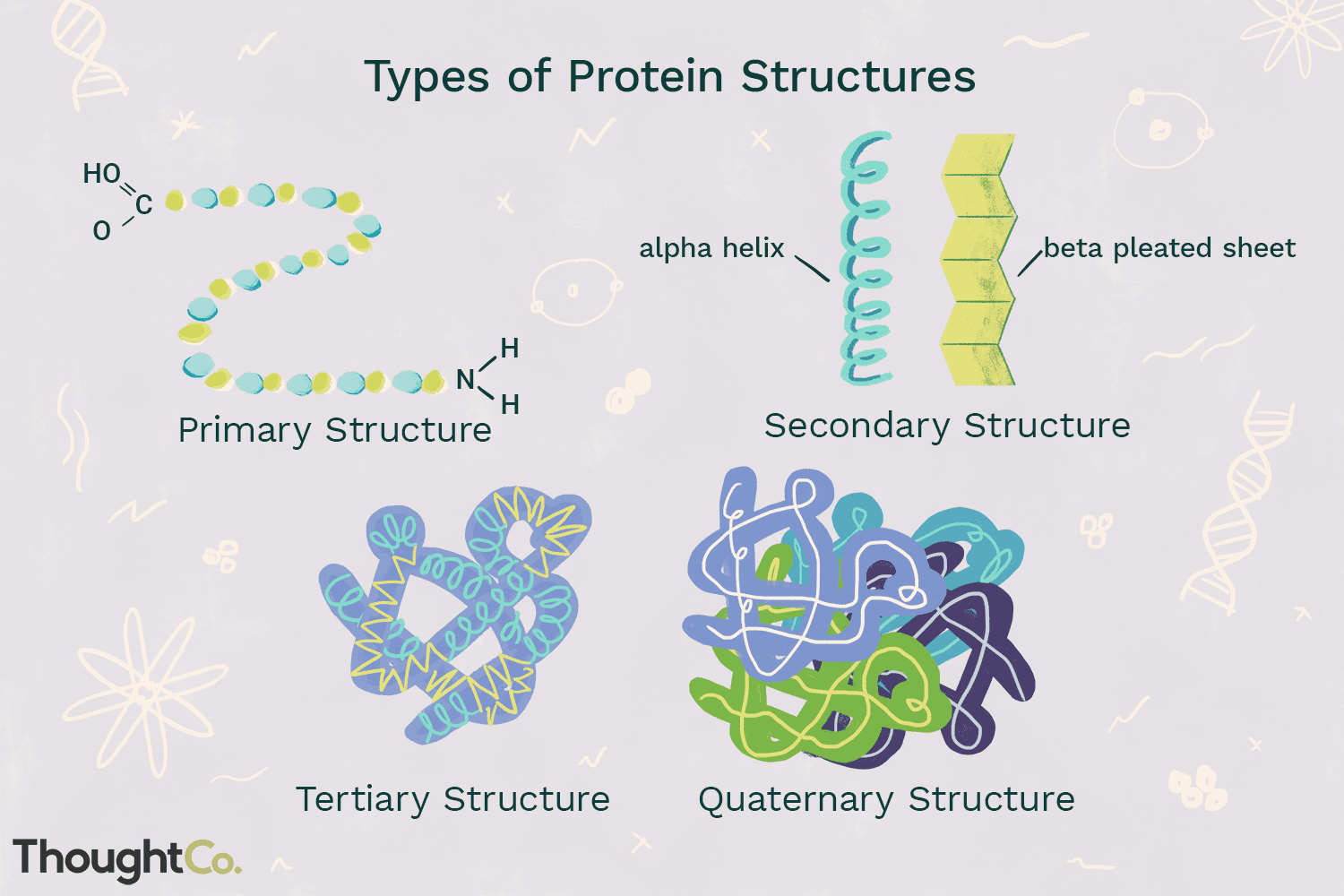
Cuatro Tipos de Estructura de Proteínas
Los cuatro niveles de estructura proteica se distinguen entre sí por el grado de complejidad en la cadena polipeptídica. Una única molécula de proteína puede contener uno o más de los tipos de estructura de proteína: estructura primaria, secundaria, terciaria y cuaternaria.
Lectura relacionada: Prefijos y Sufijos de Biología: - ase
Prefijos y Sufijos de Biología: - ase
1. Estructura Primaria
Estructura Primaria describe el orden único en el que los aminoácidos se unen para formar una proteína. Las proteínas se construyen a partir de un conjunto de 20 aminoácidos. Generalmente, los aminoácidos tienen las siguientes propiedades estructurales:
- Un carbono (el carbono alfa) unido a los cuatro grupos siguientes:
- Un átomo de hidrógeno (H)
- Un grupo carboxilo (- COOH)
- Un grupo amino (- NH2)
- Un grupo "variable" o grupo "R"
Todos los aminoácidos tienen el carbono alfa unido a un átomo de hidrógeno, un grupo carboxilo y un grupo amino. El Grupo" R" varía entre los aminoácidos y determina las diferencias entre estos monómeros de proteínas. La secuencia de aminoácidos de una proteína está determinada por la información que se encuentra en el código genético celular. El orden de los aminoácidos en una cadena polipeptídica es único y específico para una proteína particular. La alteración de un solo aminoácido provoca una mutación genética, que con mayor frecuencia da como resultado una proteína que no funciona.
Lectura relacionada: Cómo Hacer un Modelo de los Pulmones
Cómo Hacer un Modelo de los Pulmones
2. Estructura Secundaria
Estructura Secundaria se refiere al enrollamiento o plegamiento de una cadena polipeptídica que da a la proteína su forma 3-D. Hay dos tipos de estructuras secundarias observadas en las proteínas. Un tipo es el hélice alfa (α) estructura. Esta estructura se asemeja a un resorte en espiral y está asegurada por enlaces de hidrógeno en la cadena polipeptídica. El segundo tipo de estructura secundaria en las proteínas es la hoja plisada beta (β). Esta estructura parece estar plegada o plegada y se mantiene unida mediante enlaces de hidrógeno entre unidades polipeptídicas de la cadena plegada que se encuentran adyacentes entre sí.
Lectura relacionada:
 Descripción del Desierto-Descripción del Bioma Terrestre
Descripción del Desierto-Descripción del Bioma Terrestre3. Estructura Terciaria
Estructura Terciaria se refiere a la estructura 3D completa de la cadena polipeptídica de una proteína. Existen varios tipos de enlaces y fuerzas que mantienen una proteína en su estructura terciaria.
- Interacciones hidrófobas contribuyen en gran medida al plegamiento y la conformación de una proteína. El grupo" R " del aminoácido es hidrófobo o hidrófilo. Los aminoácidos con grupos "R" hidrófilos buscarán el contacto con su entorno acuoso, mientras que los aminoácidos con grupos "R" hidrófobos buscarán evitar el agua y posicionarse hacia el centro de la proteína.
- Enlaces de hidrógeno en la cadena polipeptídica y entre los grupos de aminoácidos "R" ayuda a estabilizar la estructura de la proteína manteniendo la proteína en la forma establecida por las interacciones hidrófobas.
- Debido al plegamiento de proteínas, enlace iónico puede ocurrir entre los grupos "R" cargados positiva y negativamente que entran en contacto cercano entre sí.
- El plegamiento también puede dar como resultado un enlace covalente entre los grupos" R " de aminoácidos de cisteína. Este tipo de unión forma lo que se llama un puente disulfuro. Las interacciones llamadas fuerzas de van der Waals también ayudan en la estabilización de la estructura de la proteína. Estas interacciones pertenecen a las fuerzas atractivas y repulsivas que se producen entre las moléculas que se polarizan. Estas fuerzas contribuyen a la unión que se produce entre las moléculas.
4. Estructura Cuaternaria
Estructura Cuaternaria se refiere a la estructura de una macromolécula proteica formada por interacciones entre múltiples cadenas polipeptídicas. Cada cadena polipeptídica se denomina subunidad. Las proteínas con estructura cuaternaria pueden consistir en más de una del mismo tipo de subunidad proteica. También pueden estar compuestos de diferentes subunidades. La hemoglobina es un ejemplo de una proteína con estructura cuaternaria. La hemoglobina, que se encuentra en la sangre, es una proteína que contiene hierro que se une a las moléculas de oxígeno. Contiene cuatro subunidades: dos subunidades alfa y dos subunidades beta.
Cómo Determinar el Tipo de Estructura de la Proteína
La forma tridimensional de una proteína está determinada por su estructura primaria. El orden de los aminoácidos establece la estructura y la función específica de una proteína. Las instrucciones distintas para el orden de los aminoácidos se designan por los genes en una célula. Cuando una célula percibe la necesidad de síntesis de proteínas, el ADN se desenreda y se transcribe en una copia de ARN del código genético. Este proceso se denomina transcripción del ADN. La copia de ARN se traduce entonces para producir una proteína. La información genética en el ADN determina la secuencia específica de aminoácidos y la proteína específica que se produce. Las proteínas son ejemplos de un tipo de polímero biológico. Junto con las proteínas, los carbohidratos, los lípidos y los ácidos nucleicos constituyen las cuatro clases principales de compuestos orgánicos en las células vivas.