La electroquímica es un proceso mediante el cual capas muy finas de un metal seleccionado se unen a la superficie de otro metal a nivel molecular. El proceso en sí implica la creación de una celda electrolítica: un dispositivo que utiliza electricidad para entregar moléculas a una ubicación particular.
Cómo Funciona la Galvanoplastia
La galvanoplastia es la aplicación de celdas electrolíticas en las que se deposita una fina capa de metal sobre una superficie eléctricamente conductora. Una celda consta de dos electrodos (conductores), generalmente hechos de metal, que se mantienen separados entre sí. Los electrodos se sumergen en un electrolito (una solución).
Lectura relacionada: ¿Qué Es un Cóctel Molotov?
¿Qué Es un Cóctel Molotov?
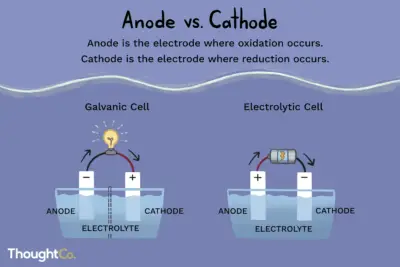
Cuando se activa una corriente eléctrica, los iones positivos en el electrolito se mueven hacia el electrodo cargado negativamente, llamado cátodo. Los iones positivos son átomos con un electrón muy poco. Cuando alcanzan el cátodo, se combinan con electrones y pierden su carga positiva.
Al mismo tiempo, los iones cargados negativamente se mueven al electrodo positivo, llamado ánodo. Los iones cargados negativamente son átomos con un electrón de más. Cuando alcanzan el ánodo positivo, transfieren sus electrones a él y pierden su carga negativa.
Lectura relacionada:
 De Qué Está Hecho El Fuego? Composición Química
De Qué Está Hecho El Fuego? Composición QuímicaEl Ánodo y el Cátodo
En una forma de galvanoplastia, el metal a recubrir se ubica en el ánodo del circuito, con el artículo a recubrir ubicado en el cátodo. Tanto el ánodo como el cátodo se sumergen en una solución que contiene una sal metálica disuelta, como un ion del metal que se está recubriendo, y otros iones que actúan para permitir el flujo de electricidad a través del circuito.
Se suministra corriente continua al ánodo, oxidando sus átomos metálicos y disolviéndolos en la solución de electrolito. Los iones metálicos disueltos se reducen en el cátodo, recubriendo el metal sobre el artículo. La corriente a través del circuito es tal que la velocidad a la que se disuelve el ánodo es igual a la velocidad a la que se chapea el cátodo.
Lectura relacionada:
 Nombres y Funciones de los Elementos Químicos en los Fuegos Artificiales
Nombres y Funciones de los Elementos Químicos en los Fuegos ArtificialesPropósito de la galvanoplastia
Hay varias razones por las que es posible que desee recubrir una superficie conductora con metal. El chapado en plata y el chapado en oro de joyas o cubiertos se realizan típicamente para mejorar la apariencia y el valor de los artículos. El cromado mejora la apariencia de los objetos y también mejora su desgaste. Se pueden aplicar revestimientos de zinc o estaño para conferir resistencia a la corrosión. A veces, la galvanoplastia se realiza simplemente para aumentar el grosor de un artículo.
Ejemplo de Galvanoplastia
Un ejemplo simple del proceso de galvanoplastia es la galvanoplastia de cobre en la que el metal a recubrir (cobre) se usa como ánodo, y la solución de electrolito contiene el ion del metal a recubrir (Cu2+ en este ejemplo). El cobre se disuelve en el ánodo a medida que se recubre en el cátodo. Una concentración constante de Cu2+ se mantiene en la solución electrolítica que rodea los electrodos:
- Ánodo: Cu (s) → Cu2+(aq) + 2 e-
- Cátodo: Cu2+(aq) + 2 e- → Cu(s)
Procesos de Galvanoplastia Comunes
| Metal | Ánodo | Electrolito | Aplicación |
| Cu | Cu | 20% CuSO4, 3% H2ENTONCES4 | electrotipo |
| Ag | Ag | 4% AgCN, 4% KCN, 4% K2CO3 | joyería, vajilla |
| Au | Au, C, Ni-Cr | 3% de AuCN, 19% de KCN, 4% de Na3PO4 tampón | joyería |
| Cr | Pb | 25% de CrO3, 0,25% de H2ENTONCES4 | piezas de automóvil |
| Ni | Ni | 30% de NiSO4, 2% de NiCl2, 1% de H3BO3 | Placa base Cr |
| Zn | Zn | 6% de Zn (CN)2, NaCN al 5%, NaOH al 4%, Na al 1%2CO3, 0,5% de Al2(ENTONCES4)3 | acero galvanizado |
| Sn | Sn | 8% de H2ENTONCES4, 3% de Sn, 10% de ácido cresol-sulfúrico | latas estañadas |