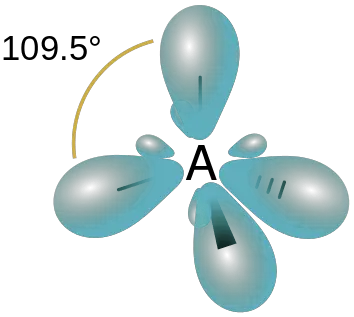
Que diferencia principal entre orbitales puros e híbridos es que el Los orbitales puros son los orbitales atómicos originales, mientras que los orbitales híbridos se forman a partir de la mezcla de dos o más orbitales atómicos.
Lectura relacionada: Diferencia entre etanol e isopropanol.
Diferencia entre etanol e isopropanol.En la formación de enlaces químicos de moléculas simples, podemos considerar simplemente la superposición de los orbitales atómicos. Pero si queremos discutir el enlace químico en moléculas complejas, necesitamos saber qué es la hibridación orbital. La hibridación orbital es el concepto químico que describe la mezcla de orbitales atómicos para formar nuevos orbitales híbridos. Estos orbitales están involucrados en la formación de enlaces químicos covalentes.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué son los orbitales puros?
3. ¿Qué son los orbitales híbridos?
4. Comparación lado a lado: orbitales puros e híbridos en forma tabular
5. Resumen
¿Qué son los orbitales puros?
Los orbitales puros son orbitales atómicos que contienen electrones del átomo. Estos orbitales no son orbitales mixtos como los orbitales híbridos. El orbital da la posición más probable de los electrones en un átomo ya que los electrones están en constante movimiento alrededor del núcleo. En lugar de una ubicación fija, esto da un área donde el electrón puede ocurrir en un momento dado.
Lectura relacionada: Diferencia entre etanol desnaturalizado y sin desnaturalizar
Diferencia entre etanol desnaturalizado y sin desnaturalizarLos orbitales atómicos puros existen en varias formas, como forma esférica, forma de mancuerna. De acuerdo con la mecánica cuántica, hay un conjunto de números cuánticos que usamos para nombrar un orbital. Este conjunto de números incluye n (número cuántico principal), l (número cuántico de momento angular), m (número cuántico magnético) y s (número cuántico de espín). Cada orbital ocupa un máximo de dos electrones. Según el número cuántico del momento angular, hay cuatro orbitales atómicos comúnmente conocidos como orbital s (esférico), orbital p (en forma de pesa), orbital d (dos pesas en el mismo plano) y orbital f (una estructura complicada).
¿Qué son los orbitales híbridos?
Los orbitales híbridos son los orbitales moleculares que se forman a partir de la mezcla de orbitales atómicos. Estos son orbitales hipotéticos. La mezcla se produce entre los orbitales atómicos de un mismo átomo. Esta mezcla se produce para formar un enlace químico covalente con otro átomo. El proceso de esta mezcla es la "hibridación orbital", que da como resultado orbitales híbridos. Nombramos estos orbitales después de los orbitales atómicos que experimentan hibridación.
En consecuencia, las tres formas principales de orbitales híbridos son:
- Orbital híbrido sp: se forma debido a la hibridación de los orbitales atómicos s y p. Por lo tanto, el orbital híbrido resultante tiene 50% de propiedades s y 50% de propiedades orbitales p. Este orbital híbrido tiene una disposición espacial lineal.
- sp2 Orbital híbrido: se forma por la hibridación de un orbital s y dos p. Por lo tanto, el orbital híbrido resultante tiene el 33% de las características del orbital s y el 66% de las características del orbital p. La disposición espacial es plana trigonal.
- sp3 Orbital híbrido: se forma por la hibridación de un orbital s y tres p. Por lo tanto, el orbital híbrido resultante tiene 25% de propiedades s y 75% de propiedades p. La disposición espacial de estos orbitales híbridos es tetraédrica.
¿Cuál es la diferencia entre orbitales puros e híbridos?
Los orbitales puros son orbitales atómicos que contienen electrones del átomo, mientras que los orbitales híbridos son los orbitales moleculares que se forman a partir de la mezcla de orbitales atómicos. Esta es la diferencia clave entre los orbitales puros e híbridos. Además, los orbitales híbridos se forman a través de la hibridación orbital, pero los orbitales puros no se hibridan. Además, la formación de orbitales híbridos es importante en la formación de compuestos químicos complicados mediante la formación de enlaces químicos covalentes. Al considerar la nomenclatura de los orbitales, nos referimos a los orbitales puros como orbitales s, p, d y f, mientras que a los orbitales híbridos nos referimos como sp, sp2sp3Etc.
La siguiente infografía tabula la diferencia entre orbitales puros e híbridos para una referencia rápida.

Resumen: orbitales puros frente a híbridos
Los orbitales atómicos son las regiones donde existen electrones en los átomos. En este artículo, hemos descrito dos tipos de orbitales como orbitales puros e híbridos. La diferencia clave entre los orbitales puros e híbridos es que los orbitales puros son los orbitales atómicos originales, mientras que los orbitales híbridos se forman a partir de la mezcla de dos o más orbitales atómicos.
Relación:
1. Letras libres. "Orbitales híbridos". Química LibreTexts, Libretexts, 21 de julio de 2016. Disponible aquí
Imagen de cortesía:
1. “AE4h” por Jfmelero - Trabajo propio, (CC BY-SA 3.0) a través de Commons Wikimedia