Que diferencia principal entre los radicales libres y las especies reactivas de oxígeno los radicales libres pueden o no contener átomos de oxígeno, mientras que las especies reactivas de oxígeno contienen esencialmente átomos de oxígeno.
Lectura relacionada: Diferencia entre el sentido Dextrogiro y el sentido Levogiro
Diferencia entre el sentido Dextrogiro y el sentido LevogiroPor lo general, usamos los términos radicales libres y especies reactivas de oxígeno indistintamente porque las especies reactivas de oxígeno siempre son compuestos de radicales libres. Sin embargo, no todos los radicales libres son especies reactivas de oxígeno; pueden o no contener átomos de oxígeno, pero son muy reactivos debido a la presencia de un electrón desapareado. Por lo tanto, estas dos formas tienden a reaccionar con fuentes adecuadas para obtener un electrón que se acoplará con su electrón desapareado para que la configuración electrónica se vuelva estable.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué son los radicales libres?
3. ¿Qué son las especies reactivas de oxígeno?
4. Comparación lado a lado: oxígeno atómico frente a especies de oxígeno molecular en forma tabular
5. Resumen
¿Qué son los radicales libres?
Los radicales libres son átomos reactivos o grupos de átomos que contienen uno o más electrones desapareados. Son altamente reactivos debido a la presencia de un electrón desapareado. Además, los radicales libres son muy inestables y tienden a estabilizarse al recibir electrones del exterior para llenar los orbitales vacíos. Reaccionan con otros compuestos químicos para capturar el electrón necesario. Los radicales libres son intermediarios importantes en los procesos naturales. Podemos indicar los radicales libres con un punto en superíndice a la derecha. Por ejemplo H, Cl.HO.H3C.
Lectura relacionada: Diferencia entre la datación por carbono y la datación por uranio.
Diferencia entre la datación por carbono y la datación por uranio.
Figura 01: radical hidroxilo
Los radicales libres persistentes se dividen en tres categorías: radicales estables, radicales persistentes y dirradicales.
Lectura relacionada: Diferencia entre el ácido benzoico y el benzoato de sodio.
Diferencia entre el ácido benzoico y el benzoato de sodio.- Radicales estables: el ejemplo más importante de un radical estable es el oxígeno molecular O2. Los radicales orgánicos que contienen un sistema π conjugado pueden vivir durante mucho tiempo.
- Radicales persistentes: son de larga vida debido al apiñamiento estérico alrededor del centro radical, lo que dificulta físicamente que reaccionen con otra molécula.
- Dirradicales: Algunas moléculas tienen dos centros radicales; los llamamos dirradicales. El oxígeno molecular (oxígeno en el aire) existe naturalmente como un dirradical.
¿Qué son las especies reactivas de oxígeno?
Las especies reactivas de oxígeno son radicales que son altamente reactivos y contienen electrones desapareados. La designación para este término es ROS. Estas especies químicas contienen esencialmente átomos de oxígeno que contienen un electrón desapareado. Algunos ejemplos comunes son peróxido, superóxido, radicales hidroxilo, oxígeno alfa, etc.

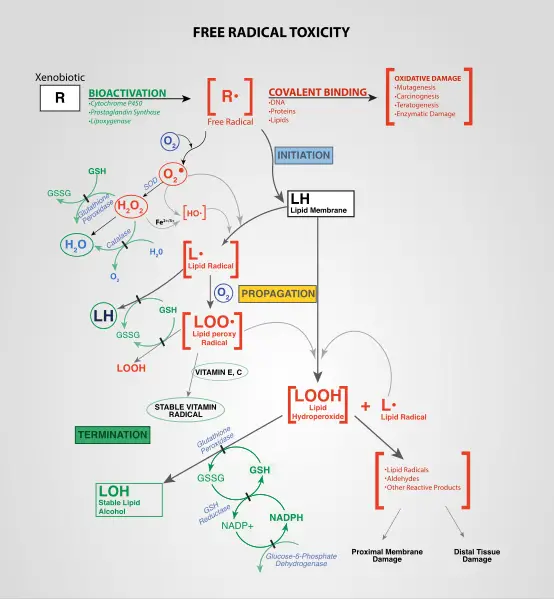
Figura 02: Formación endógena de ROS
Varias reacciones químicas forman estas especies reactivas de oxígeno; Por ejemplo, la reducción de oxígeno molecular forma superóxido, y esta especie de oxígeno reactivo actúa como precursor de muchas otras formaciones de radicales. Los peróxidos son otro tipo importante de ROS que se forma a partir de la dismutación del superóxido.
Existen vías endógenas y exógenas para la producción de ROS. Por ejemplo, las especies reactivas de oxígeno se forman en diversas reacciones biológicas dentro de las células y los orgánulos, como los peroxisomas. La producción exógena de ROS se refiere a la formación de especies reactivas de oxígeno debido a la influencia de agentes externos como contaminantes, metales pesados, humo, drogas, etc.
¿Cuál es la diferencia entre los radicales libres y las especies reactivas de oxígeno?
Por lo general, usamos los términos radicales libres y especies reactivas de oxígeno indistintamente porque las especies reactivas de oxígeno siempre son compuestos de radicales libres. Sin embargo, no todos los radicales libres son especies reactivas de oxígeno. La diferencia clave entre los radicales libres y las especies reactivas de oxígeno es que los radicales libres pueden o no contener átomos de oxígeno, mientras que las especies reactivas de oxígeno esencialmente contienen átomos de oxígeno.
A continuación se muestra un resumen de la diferencia entre los radicales libres y las especies reactivas de oxígeno.

Resumen: radicales libres frente a especies reactivas de oxígeno
Los radicales libres son átomos reactivos o grupos de átomos que contienen uno o más electrones desapareados, mientras que las especies de oxígeno reactivo son radicales que son altamente reactivos y contienen electrones desapareados. La diferencia clave entre los radicales libres y las especies reactivas de oxígeno es que los radicales libres pueden o no contener átomos de oxígeno, mientras que las especies reactivas de oxígeno esencialmente contienen átomos de oxígeno.
Relación:
1. "Especies reactivas de oxígeno". Wikipedia, Fundación Wikimedia, 4 de noviembre de 2019, disponible aquí.
2. "¿Qué son los radicales libres?" Fitoquímicos, disponibles aquí.
3. "Radical (química)". Wikipedia, Fundación Wikimedia, 27 de noviembre de 2019, disponible aquí.
Imagen de cortesía:
1. "Radical hidroxilo" por SmokeyJoe - Trabajo propio (CC BY-SA 4.0) a través de Commons Wikimedia
2. "Toxicidad de radicales libres" por Dan Cojocari - Trabajador propio (CC BY-SA 4.0) a través de Commons Wikimedia