
Que diferencia principal entre la reacción de turno simple y la de turno doble es que En las reacciones de desplazamiento simple, una especie química reemplaza parte de otra especie química, mientras que en las reacciones de desplazamiento doble, dos especies iónicas se intercambian entre dos moléculas. suceder.
Lectura relacionada: Diferencia entre etilamina y dietilamina.
Diferencia entre etilamina y dietilamina.Las reacciones de desplazamiento simple y desplazamiento doble son reacciones químicas importantes que involucran tanto la formación como la ruptura de enlaces. Por lo tanto, es importante conocer la diferencia exacta entre la reacción de un solo turno y la de doble turno.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es una reacción de turno único?
3. ¿Qué es una reacción de doble turno?
4. Comparación lado a lado: respuesta de desplazamiento simple frente a desplazamiento doble en forma tabular
5. Resumen
¿Qué es una reacción de desplazamiento simple?
Una reacción de desplazamiento simple es un tipo de reacción química en la que una especie química reemplaza parte de otra especie química. Para que ocurra este tipo de reacción, debe haber una especie reactiva que pueda reemplazar parte de una molécula (por ejemplo, un grupo funcional). Muy a menudo, la especie reactiva es un catión, un anión o un metal. La fórmula general para este tipo de reacciones es la siguiente:
Lectura relacionada: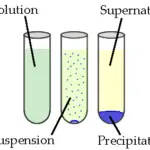 Diferencia entre reacción ácido-base y reacción de precipitación.
Diferencia entre reacción ácido-base y reacción de precipitación.AB + C ⟶ A + BC
Aquí B es parte de la molécula AB y se reemplaza por una especie reactiva C. Después de eso, se forma la molécula BC. Podemos predecir el resultado de una reacción de desplazamiento observando la serie de reactividad. Aquí, los elementos químicos en la parte superior de la fila pueden reemplazar a los elementos químicos en la parte inferior de la fila. Consideremos un ejemplo;
Zn + 2HCl ⟶ ZnCl2 +H2
Lectura relacionada: Diferencia entre etilamina y anilina.
Diferencia entre etilamina y anilina.En el ejemplo anterior, Zn está en la parte superior de la serie de reactividad mientras que H está en la parte inferior; por lo tanto, Zn puede desplazar H en HCl, formando ZnCl2.
¿Qué es una reacción de doble turno?
Las reacciones de doble desplazamiento son un tipo de reacción química en la que hay un intercambio de dos especies iónicas entre dos moléculas. La fórmula general es la siguiente:
AB + CD ⟶ AC + BD

Figura 01: Precipitación de plata sobre cobre
El enlace que se rompe y se forma durante esta reacción puede ser iónico o covalente. Algunos ejemplos de este tipo de reacciones incluyen reacciones de precipitación, reacciones ácido-base, alquilación, etc.
¿Cuál es la diferencia entre la reacción de turno simple y la de turno doble?
Las reacciones de desplazamiento simple y doble son dos tipos de reacciones químicas que son importantes para aislar el componente deseado de una solución. La principal diferencia entre las reacciones de desplazamiento simple y de doble desplazamiento es que en las reacciones de desplazamiento simple, una especie química reemplaza parte de otra especie química, mientras que en las reacciones de doble desplazamiento hay un intercambio de dos especies iónicas entre dos moléculas. Las reacciones de desplazamiento simple deben tener una especie reactiva que pueda reemplazar un grupo funcional, mientras que las reacciones de doble desplazamiento deben tener iones intercambiables. Entonces, esta es otra diferencia entre la reacción de un solo turno y la de doble turno.
Además, Zn desplaza H en HCl para formar ZnCl2 es un ejemplo de reacción de desplazamiento simple, mientras que las reacciones de precipitación, reacciones ácido-base, alquilación, etc. son ejemplos de reacciones de doble desplazamiento.

Resumen - Respuesta de turno simple frente a turno doble
Las reacciones de desplazamiento simple y doble son dos tipos de reacciones químicas que son importantes para aislar el componente deseado de una solución. La principal diferencia entre las reacciones de desplazamiento simple y de doble desplazamiento es que en las reacciones de desplazamiento simple, una especie química reemplaza parte de otra especie química, mientras que en las reacciones de doble desplazamiento hay un intercambio de dos especies iónicas entre dos moléculas.
Relación
1. "11.7: Reacciones de intercambio individuales". Química LibreTextsLibretexts, 5 de junio de 2019, Disponible aquí.
Imagen de cortesía:
1. "Precipitación de plata sobre cobre 2" por Toby Hudson - Trabajo propio (CC BY-SA 3.0 au) a través de Commons Wikimedia











