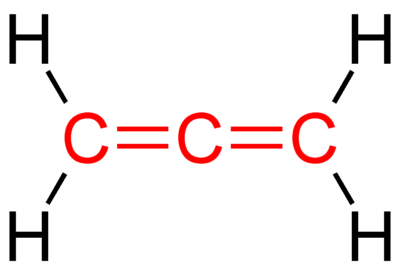
Diferencia clave: acetileno vs etileno
Que diferencia principal entre el acetileno y el etileno es que El acetileno tiene un enlace triple entre dos átomos de carbono, mientras que el etileno tiene un enlace doble entre dos átomos de carbono..
Los nombres acetileno y etileno suenan similares, pero son compuestos de hidrocarburos diferentes. Sin embargo, también tienen algunas similitudes. Este artículo describe tanto las similitudes como las diferencias entre el acetileno y el etileno.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es el acetileno?
3. ¿Qué es el etileno?
4. Similitudes entre acetileno y etileno
5. Comparación lado a lado: acetileno frente a etileno en forma tabular
6. Resumen
 Diferencia entre metales de transición y metaloides.
Diferencia entre metales de transición y metaloides.¿Qué es el acetileno?
El acetileno es un compuesto orgánico con la fórmula química C2H2. También es el alquino más simple entre los hidrocarburos. Un alquino es un compuesto con un triple enlace entre dos átomos de carbono. Por lo tanto, el acetileno tiene un triple enlace entre los dos átomos de carbono que tiene. Hay dos enlaces pi y un enlace sigma entre estos átomos de carbono. La molécula tiene una geometría lineal porque un átomo de carbono solo puede formar cuatro enlaces covalentes (el acetileno tiene un enlace triple y un enlace simple, CH, lo que hace que la molécula sea lineal). Por lo tanto, los átomos de carbono de la molécula de acetileno tienen hibridación sp.
Propiedades químicas del acetileno
Algunos datos químicos sobre el acetileno son los siguientes:
- Fórmula química = C2H2
- masa molar = 26,04 g/mol
- Estado físico a temperatura ambiente = es un gas incoloro
- Olor = inodoro
- Punto de fusión = -80,8°C
- Punto de ebullición = -84°C
- Solubilidad en agua = ligeramente soluble
- Nombre IUPAC = Ethin
Además, el acetileno no existe como líquido a presión atmosférica. Por lo tanto, no tiene un punto de fusión real. El punto de fusión dado anteriormente es en realidad el punto triple del acetileno. Por lo tanto, la forma sólida de acetileno está sujeta a sublimación en lugar de fusión. Allí, el acetileno sólido se convierte en vapor.
Lectura relacionada: Diferencia entre acetato de metilo y acetato de etilo.
Diferencia entre acetato de metilo y acetato de etilo.
Figura 01: Uso de llama de oxiacetileno
El principal uso del acetileno es en los procesos de soldadura. La llama de acetileno-oxígeno es una llama de alta temperatura que es importante en la soldadura y el corte. Podemos crear esta llama quemando acetileno con oxígeno.
Lectura relacionada: Diferencia entre dismutación y desproporción
Diferencia entre dismutación y desproporción¿Qué es el etileno?
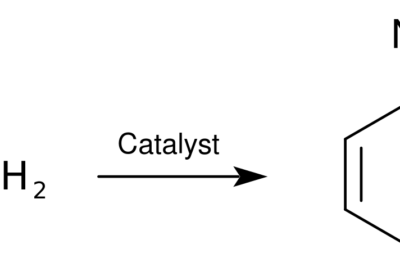
El etileno es un compuesto orgánico con la fórmula química C2H4. Hay dos átomos de carbono que están unidos por un doble enlace (un enlace pi y un enlace sigma). Por lo tanto, la molécula de etileno tiene dos átomos de carbono con hibridación sp2. Dado que un átomo de carbono puede formar cuatro enlaces químicos, dos átomos de hidrógeno están unidos a cada átomo de carbono mediante enlaces simples. Entonces la molécula de etileno tiene una estructura plana.

Figura 02: La estructura química del etileno.
Algunos datos químicos sobre el etileno son los siguientes:
- Fórmula química = C2H4
- masa molar = 28,05 g/mol
- Estado físico a temperatura ambiente = es un gas incoloro e inflamable
- olor = olor dulce
- Punto de fusión = -169,2°C
- Punto de ebullición = -103,7°C
- Solubilidad en agua = ligeramente soluble
- Nombre IUPAC = eteno
Las principales fuentes de etileno son el petróleo crudo y el gas natural. Hay tres procesos principales para producir etileno a partir de estas fuentes. Están;
- Craqueo al vapor de etano y propano
- Craqueo al vapor de nafta
- Craqueo catalítico de gasóleo
El etileno tiene usos importantes como monómero para la producción de polímeros como el polietileno por polimerización por adición. El polietileno es un material de embalaje común. Además, el etileno es importante como hormona vegetal en los sistemas biológicos porque estimula el proceso de maduración de la fruta.
¿Cuáles son las similitudes entre el acetileno y el etileno?
- Ambos son pequeños hidrocarburos.
- El acetileno y el etileno están formados únicamente por átomos de carbono y átomos de hidrógeno.
- Ambos son gases incoloros.
- Tanto el acetileno como el etileno son gases inflamables.
- El acetileno y el etileno son estructuras planas.
¿Cuál es la diferencia entre el acetileno y el etileno?
acetileno versus etileno |
|
| El acetileno es un compuesto orgánico con la fórmula química C2H2. | El etileno es un compuesto orgánico con la fórmula química C2H4. |
| número de átomos de hidrógeno | |
| El acetileno tiene dos átomos de hidrógeno en una molécula de acetileno. | El etileno tiene cuatro átomos de hidrógeno en una molécula de etileno. |
| masa molar | |
| La masa molar del acetileno es 26,04 g/mol. | La masa molar del etileno es 28,05 g/mol. |
| enlace químico | |
| El acetileno tiene un enlace triple entre dos átomos de carbono y dos enlaces simples CH. | El etileno tiene un enlace doble entre dos átomos de carbono y cuatro enlaces simples CH. |
| Hibridación de átomos de carbono. | |
| Los átomos de carbono de la molécula de acetileno tienen hibridación sp. | Los átomos de carbono de la molécula de etileno tienen hibridación sp2. |
Resumen - acetileno vs etileno
El acetileno y el etileno son compuestos de hidrocarburos muy importantes debido a su amplia gama de usos. La diferencia entre el acetileno y el etileno es que el acetileno tiene un enlace triple entre dos átomos de carbono, mientras que el etileno tiene un enlace doble entre dos átomos de carbono.
Relación:
1. "Acetileno". Wikipedia, Fundación Wikimedia, 14 de abril de 2018. Disponible aquí
2. "Etileno". Wikipedia, Fundación Wikimedia, 18 de abril de 2018. Disponible aquí
3. “Acetileno”. Centro Nacional de Información Biotecnológica. Base de datos compuesta de PubChem, Biblioteca Nacional de Medicina de EE. UU. Disponible aquí
Imagen de cortesía:
1.'US Navy 070413-N-2943C-001 El técnico de casco Troy Heffner enciende un soplete de acetil-oxígeno antes de un trabajo de soldadura en la tienda de técnicos de casco'By Foto de la Marina de los EE. UU. por el especialista en comunicación de masas Carlos Cepeda (dominio público) a través de Commons Wikipedia
2.'Ethylene-3D-balls'By Benjah-bmm27 - Trabajo propio, (Dominio público) a través de Commons Wikimedia