Que diferencia principal entre el cloroformo y el tetracloruro de carbono que es el cloroformo (CHCl3) es un anestésico potente, pero el tetracloruro de carbono (CCl4) no es un anestésico.
Además, tanto el cloroformo como el tetracloruro de carbono tienen la misma geometría química; geometría tetraédrica. Debido a que la estructura química y la composición del tetracloruro de carbono es similar al cloroformo, la mayoría de las personas no entienden que piensan que los dos son iguales. Sin embargo, el tetracloruro de carbono solo tiene átomos de carbono y cloro, mientras que el cloroformo tiene átomos de carbono, cloro e hidrógeno.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es el cloroformo?
3. ¿Qué es el tetracloruro de carbono?
4. Comparación lado a lado: cloroformo frente a tetracloruro de carbono en forma tabular
5. Resumen
 Diferencia entre sulfonato y sulfato.
Diferencia entre sulfonato y sulfato.¿Qué es el cloroformo?
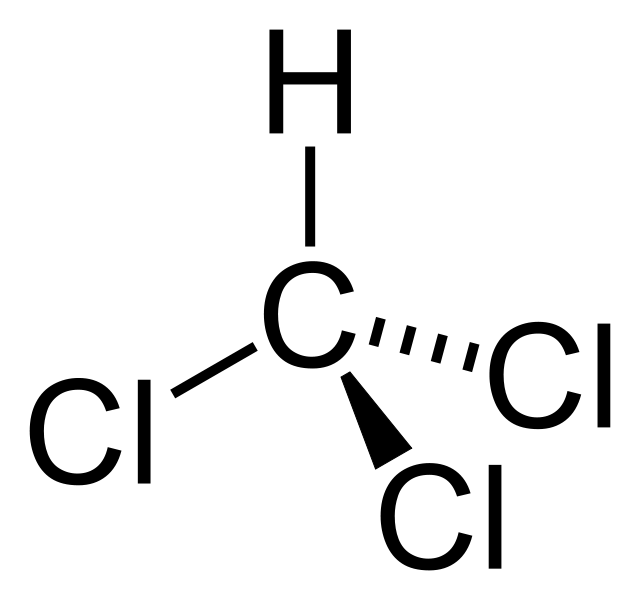
El cloroformo es CHCl3 , que se utiliza como un poderoso anestésico. El nombre IUPAC para este compuesto es triclorometano. Es un líquido incoloro y denso que tiene un olor dulce. El propósito de la producción a gran escala de este compuesto es usarlo como precursor para la fabricación de PTFE. La mayor parte del cloroformo en el medio ambiente (alrededor del 90%) se debe a emisiones de origen natural. Ejemplo: Muchos tipos de algas y hongos producen este compuesto.
La masa molar del compuesto es 119,37 g/mol y aparece como un líquido incoloro a temperatura ambiente. Tiene un fuerte olor etéreo. El punto de fusión es de -63,5 °C y el punto de ebullición es de 61,15 °C. Además, se descompone a 450 °C. La molécula de cloroformo tiene una geometría tetraédrica.

 Diferencia entre alfa y beta hidroxiácidos
Diferencia entre alfa y beta hidroxiácidosFigura 01: Estructura química del cloroformo
A escala industrial, podemos hacer este compuesto calentando una mezcla de cloro y clorometano (a veces también usamos metano). Al calentar, la halogenación radical tiene lugar a 400–500 °C. Allí, se forman los compuestos clorados de clorometano (o metano), produciendo cloroformo. Allí, este compuesto se puede clorar más para formar tetracloruro de carbono. Sin embargo, el producto final de esta reacción es una mezcla de clorometanos, que podemos separar por destilación para obtener cloroformo.
Hay muchos usos del cloroformo. Es útil como solvente porque el átomo de hidrógeno en esta molécula puede formar un enlace de hidrógeno. También podemos usarlo como reactivo para muchas reacciones químicas. Ej: como fuente del grupo diclorocarbeno. Más importante aún, el cloroformo es conocido por sus propiedades anestésicas.
Lectura relacionada: Diferencia entre radical y valencia.
Diferencia entre radical y valencia.¿Qué es el tetracloruro de carbono?
El tetracloruro de carbono es CCl4 , que comúnmente llamamos “tetraclorometano”. Es un líquido incoloro de olor dulce. Podemos reconocerlo por su olor incluso en bajas concentraciones. En la industria de la limpieza, el nombre común de este compuesto es carbon tet.
La masa molar es 153,81 g/mol. El punto de fusión es de -22,92 °C y el punto de ebullición es de 76,72 °C. La geometría de esta molécula es geometría tetraédrica. Como cuatro átomos de cloro están unidos a un solo átomo de carbono, los ángulos de enlace de las moléculas son iguales. Lo llamamos una "geometría simétrica". Debido a esta geometría, el compuesto no es polar. Se asemeja a la estructura de una molécula de metano, con cuatro átomos de hidrógeno unidos a un solo átomo de carbono.

Figura 02: Estructura química del tetracloruro de carbono
Hay muchos usos del tetracloruro de carbono. Antes de la prohibición, este compuesto se usaba a gran escala para fabricar CFC. Hoy en día no producimos CFC ya que daña la capa de ozono. El tetracloruro de carbono es el ingrediente principal de las lámparas de lava. Solía ser un solvente popular, pero ahora ya no lo usamos debido a sus efectos nocivos para la salud. También lo usamos ampliamente en extintores de incendios, como precursor de refrigerante y como agente de limpieza.
¿Cuál es la diferencia entre el cloroformo y el tetracloruro de carbono?
El cloroformo es CHCl3 y es útil como un poderoso anestésico. El tetracloruro de carbono es CCl4, lo que comúnmente llamamos “tetraclorometano” no es un anestésico. Esta es la diferencia clave entre el cloroformo y el tetracloruro de carbono. Además, según la estructura molecular, el cloroformo tiene cinco átomos; un átomo de carbono, un átomo de hidrógeno y tres átomos de cloro, y la geometría molecular es una geometría asimétrica tetraédrica. Pero aunque el tetracloruro de carbono también tiene cinco átomos, tiene un átomo de carbono y cuatro átomos de cloro, y la geometría molecular es geometría simétrica tetraédrica. Además, considerando sus propiedades, la masa molar del cloroformo es de 119,37 g/mol. Aparece como un líquido denso e incoloro y tiene un fuerte olor etéreo. Mientras que la masa molar del tetracloruro de carbono es de 153,81 g/mol. Aparece como un líquido incoloro y tiene un olor dulce. La siguiente infografía proporciona más detalles sobre la diferencia entre el cloroformo y el tetracloruro de carbono en forma tabular.
Resumen: cloroformo frente a tetracloruro de carbono
Debido a que tanto el cloroformo como el tetracloruro de carbono son similares en estructura y composición química, la mayoría de las personas los confunden con el mismo compuesto. Pero el tetracloruro de carbono solo tiene átomos de carbono y cloro, mientras que el cloroformo tiene átomos de carbono, cloro e hidrógeno. Además, la principal diferencia entre el cloroformo y el tetracloruro de carbono es que podemos usar el cloroformo como un anestésico potente, pero no podemos usar el tetracloruro de carbono como anestésico.
Relación:
1. "Cloroformo". Centro Nacional de Información Biotecnológica. Base de datos compuesta de PubChem, Biblioteca Nacional de Medicina de EE. UU. Disponible aquí
2. “Tetracloruro de carbono”. Centro Nacional de Información Biotecnológica. Base de datos compuesta de PubChem, Biblioteca Nacional de Medicina de EE. UU. Disponible aquí
Imagen de cortesía:
1. "Cloroformo indicado" Por Benjah-bmm27 Vectorizado por Fvasconcellos (Dominio público) a través de Commons Wikimedia
2. "Tetraclorometano" por NEUROtiker (conferencia) - Trabajo propio, (Dominio público) a través de Commons Wikimedia