Que diferencia principal entre hidratación e hidrogenación es que La hidratación se refiere a la adición de moléculas de agua a un compuesto orgánico, mientras que la hidrogenación se refiere a la adición de una molécula de hidrógeno a un compuesto orgánico.
La hidratación y la hidrogenación son importantes en las reacciones de síntesis química. Ambas reacciones involucran la apertura de un doble enlace en un compuesto orgánico al agregar un sustituyente a los átomos de carbono en el doble enlace. Los sustituyentes agregados en estos métodos difieren entre sí.
CONTENIDO
1. Descripción general y diferencia clave
2. ¿Qué es la hidratación?
3. ¿Qué es la hidrogenación?
4. Comparación lado a lado: hidratación frente a hidratación en formato tabular
5. Resumen
 Diferencia entre isopoli y heteropoliácidos.
Diferencia entre isopoli y heteropoliácidos.¿Qué es la hidratación?
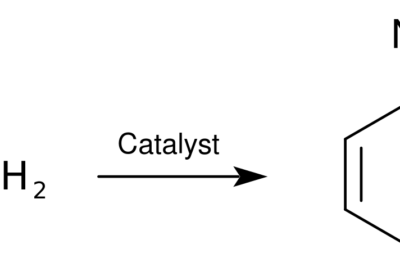
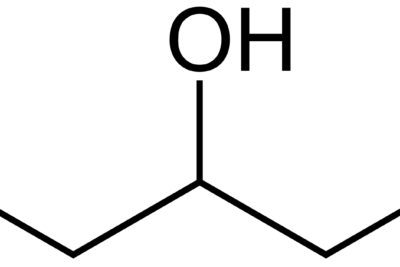
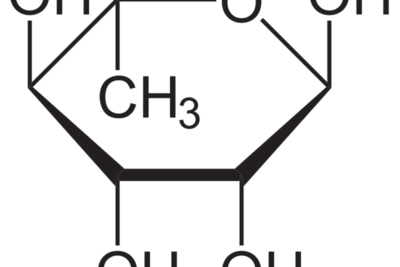
La hidratación es la adición de una molécula de agua a un compuesto orgánico. El compuesto orgánico suele ser un alqueno que tiene un doble enlace entre dos átomos de carbono. La molécula de agua está unida a este doble enlace en forma de grupo hidroxilo (OH–) y un protón (H+). Por tanto, antes de esta adición, la molécula de agua se disocia en sus iones. El grupo hidroxilo está unido a un átomo de carbono del doble enlace, mientras que el protón está unido al otro átomo de carbono.

Figura 01: Una reacción de hidratación simple
Lectura relacionada: Diferencia entre selenio y telurio.
Diferencia entre selenio y telurio.Debido a que implica la ruptura y la formación de enlaces, la reacción es altamente exotérmica. Eso significa; la reacción libera energía en forma de calor. Es una reacción gradual; en el primer paso, el alqueno actúa como nucleófilo y ataca al protón de la molécula de agua y se une a él a través del átomo de carbono menos sustituido. Aquí sigue la reacción de la regla de Markonikov.
El segundo paso implica la unión del átomo de oxígeno de la molécula de agua al otro átomo de carbono (átomo de carbono altamente sustituido) del doble enlace. En este punto, el átomo de oxígeno de la molécula de agua lleva una carga positiva porque tiene tres enlaces simples. Luego viene otra molécula de agua, recogiendo el protón adicional de la molécula de agua unida, dejando el grupo hidroxilo en el átomo de carbono menos sustituido. Por lo tanto, esta reacción conduce a la formación de un alcohol. Sin embargo, los alquinos (hidrocarburos que contienen enlaces triples) también pueden sufrir una reacción de hidratación.
¿Qué es la hidrogenación?
La hidrogenación es el proceso de agregar una molécula de hidrógeno a un compuesto orgánico. Además, esta reacción implica tratar un compuesto orgánico con gas hidrógeno. La reacción suele tener lugar en presencia de un catalizador como el níquel, el paladio o el platino. Las hidrogenaciones no catalíticas solo son posibles a temperaturas muy altas. Este método también es importante en la reducción de compuestos orgánicos insaturados. Eso significa; la hidrogenación puede abrir enlaces dobles o enlaces triples en compuestos orgánicos y transformarlos en compuestos con enlaces simples.
Lectura relacionada: Diferencia entre la reacción de Finkelstein y Swarts
Diferencia entre la reacción de Finkelstein y SwartsEl proceso de hidrogenación consta de tres componentes: sustrato insaturado, fuente de hidrógeno y catalizador. Las condiciones de reacción, como la temperatura y la presión, varían según la naturaleza del compuesto insaturado y el catalizador. El sustrato puede ser un alqueno o un alquino. La hidrogenación puede ocurrir de dos formas: catálisis homogénea y catálisis heterogénea.
En la catálisis homogénea, el metal catalizador se combina con el alqueno y el hidrógeno para formar un intermedio (complejo intermedio alqueno-catalizador-hidrógeno). Luego se produce la transferencia de un átomo de hidrógeno del metal al carbono en el doble enlace (o triple enlace). Luego ocurre la transferencia del otro átomo de hidrógeno de la fuente de hidrógeno al grupo alquilo con la disociación concomitante del alcano.

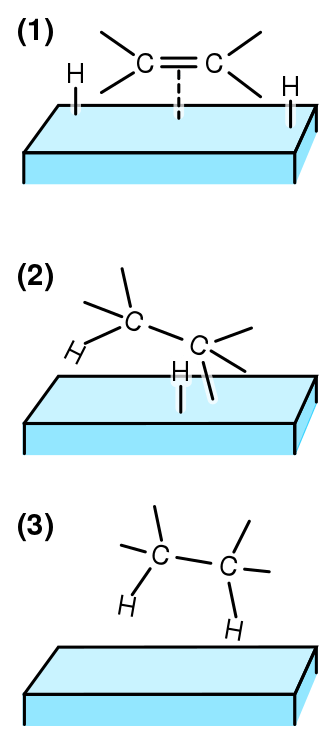
Figura 02: Tres etapas de hidrogenación
En la catálisis heterogénea, el enlace insaturado se une al catalizador mientras que la fuente de hidrógeno se disocia en dos átomos de hidrógeno. Luego ocurre un paso reversible en el que un átomo de hidrógeno se une al enlace insaturado. Finalmente, tiene lugar una reacción irreversible, en la que el otro átomo de hidrógeno se une al grupo alquilo.
¿Cuál es la diferencia entre hidratación e hidrogenación?
La hidratación y la hidrogenación son procesos importantes en la síntesis química. los diferencia clave entre hidratación e hidrogenación es que la hidratación se refiere a la adición de moléculas de agua a un compuesto orgánico, mientras que la hidrogenación se refiere a la adición de una molécula de hidrógeno a un compuesto orgánico.
Resumen - Hidratación vs. Hidratación
La hidratación y la hidrogenación son procesos importantes en la síntesis química. los diferencia clave entre hidratación e hidrogenación es que la hidratación se refiere a la adición de moléculas de agua a un compuesto orgánico, mientras que la hidrogenación se refiere a la adición de una molécula de hidrógeno a un compuesto orgánico.
Relación:
1. "Especificación para electrodos selectivos de iones, electrodos de referencia, electrodos combinados y dispositivos de medición con electrodos selectivos de iones para la determinación de iones en solución" doi:10.3403/00222406u.
Imagen de cortesía:
1. "Reacción de hidratación" por Ccroberts - Trabajo propio (Dominio público) a través de Commons Wikimedia
2. "Hidrogenación en el catalizador" Por Michael Schmid: dibujo creado por él mismo (CC BY-SA 4.0) a través de Commons Wikimedia