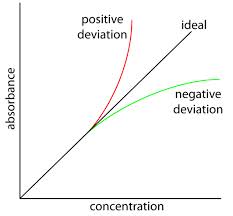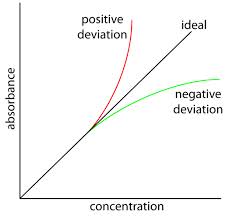
La ley de absorción de Beer-Lambert es una relación generalmente aceptada que ayuda a calcular la concentración de una especie absorbente a partir de valores de absorbancia medidos. En condiciones ideales, la gráfica de absorbancia versus concentración es una línea recta que pasa por el origen. En situaciones reales, sin embargo, se observa una curvatura en el gráfico por encima de una determinada concentración. La curvatura puede ser positiva o negativa, según la naturaleza de las especies absorbentes y las condiciones experimentales. Las desviaciones de la ley se discutieron en un artículo anterior. Este artículo discute las razones responsables de tales desviaciones.
Se observan desviaciones positivas cuando los valores de absorbancia medidos son superiores a los valores teóricos esperados y se producen desviaciones negativas cuando los valores medidos son inferiores a los valores teóricos.
Limitaciones de la ley
Cerveza: la ley de Lambert generalmente se comporta idealmente para concentraciones por debajo de un límite crítico. Para la mayoría de las moléculas absorbentes, se observa un comportamiento no lineal a concentraciones superiores a 10 mM. Sin embargo, algunas moléculas absorbentes como el azul de metileno tienden a exhibir desviaciones de la linealidad en concentraciones tan bajas como 10 µM. Las interacciones solutos-solventes en concentraciones más altas e incluso los enlaces de hidrógeno son responsables de tales anomalías.
Lectura relacionada: Derrames peligrosos de laboratorio
Derrames peligrosos de laboratorioFactores químicos
Cambio en el pH
Algunas moléculas absorbentes experimentan un cambio de color con un cambio en el pH del medio solvente. Un ejemplo es el rojo de fenol, que cambia de color de amarillo en medios ácidos a rojo en medios básicos debido a la migración interna de protones acompañada de un cambio entre un enlace simple y uno doble adyacente.
Otro ejemplo es una solución acuosa de dicromato de potasio que cambia de amarillo a naranja cuando la concentración de iones de hidrógeno aumenta como resultado de la conversión cromato-dicromato.
Lectura relacionada: 10 consejos para convertirse en un estudiante eficaz
10 consejos para convertirse en un estudiante eficaz\(2CrO_7^2^- + 2 H^+\) \(\rightleftarrows\) \(Cr_2O_7^2^- +H_2O\)
cromato bicromato
(Amarillo naranja)
Complejación, disociación o asociación
La formación de complejos por asociación puede conducir a cambios de color con cambios de concentración. Un ejemplo es el cloruro de cobalto que cambia de color de verde a azul por asociación
Lectura relacionada: Prueba de eficacia conservante
Prueba de eficacia conservante\(2CoCl_2\) \(\rightleftarrows\) \(Co(CoCl_4)\)
(Rosado azul)
El grado de asociación aumenta con el aumento de la concentración.
Factores instrumentales
Selección de longitud de onda
La ley de Beer-Lambert se aplica estrictamente a la luz con una sola longitud de onda. Sin embargo, las ineficiencias del monocromador aíslan un rango de longitudes de onda. Además, la luz parásita también es el resultado de reflejos internos de componentes ópticos como rejillas, lentes y ventanas ópticas. La absorción debida a contribuciones de luz parásita mostrará desviaciones de la ley de Beer-Lambert
Desajuste de solución y celdas.
Las variaciones en la composición de la muestra y las soluciones en blanco de referencia o el desajuste óptico de las ventanas de la cubeta darán lugar a desviaciones de la ley de Beer-Lambert.
Para minimizar las desviaciones, se deben tomar las siguientes precauciones al leer la absorbancia de las soluciones para obtener una alta precisión de los resultados:
- Utilice siempre un par de celdas de medición acopladas ópticamente
- La concentración de analito debe estar por debajo del rango lineal del diagrama de Beer-Lambert.
- El pH debe mantenerse en el valor especificado tanto para las soluciones en blanco como para las muestras.
- La composición de la solución en blanco y de la muestra debe coincidir lo más posible.