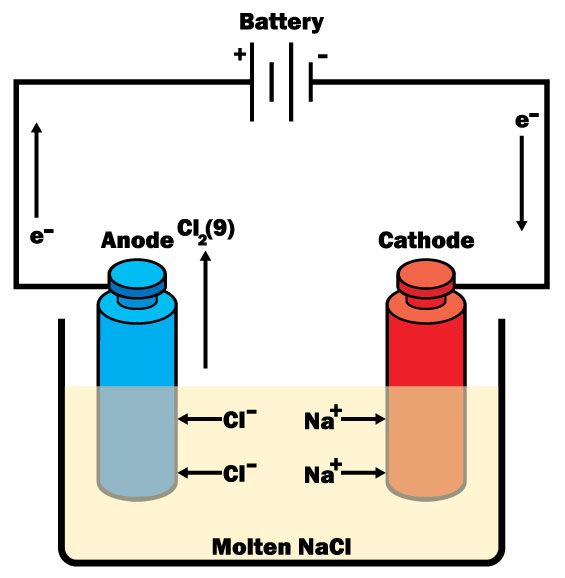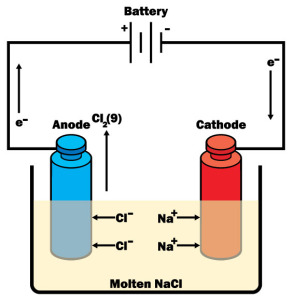
Las reacciones electroquímicas implican el intercambio de electrones entre reactivos y productos. Dicho proceso puede inducirse aplicando energía eléctrica a electrodos colocados en soluciones eléctricamente conductoras. En términos generales, las técnicas electroanalíticas implican la medición de la diferencia de potencial, la corriente o la conductividad de las soluciones y se agrupan en las siguientes categorías:
- potenciometría
- Amperometría
- voltamperometría
- Electrogravimetría y coulometría
- conductimetría
potenciometría
La potenciometría consiste en medir la diferencia de potencial entre los electrodos indicador y de referencia sumergidos en la solución de ensayo. En el caso de la titulación potenciométrica, la diferencia de potencial se grafica frente al volumen de reactivo agregado y el punto de equivalencia se lee en el gráfico.
Medir el pH también es una forma de potenciometría en la que el potencial del electrodo de vidrio se mide en función de la concentración de iones de hidrógeno en la solución. Las valoraciones basadas en el pH son populares en los procesos químicos y bioquímicos y en el control de los procesos de tratamiento de aguas residuales. En el laboratorio, la titulación potenciométrica se utiliza en gran medida para determinar los puntos finales en las titulaciones redox.
Lectura relacionada: Análisis espectroscópico
Análisis espectroscópicoAmperometría
La amperometría consiste en medir la corriente entre dos electrodos a una diferencia de potencial constante. La corriente se grafica contra el volumen de titrante para encontrar el punto final de la titración.
Las titulaciones amperométricas están libres de errores personales derivados de la estimación de los cambios de color en las titulaciones del indicador visual a medida que se alcanza el punto final mediante la extrapolación de los segmentos gráficos antes y después del punto final. Se pueden realizar valoraciones amperométricas adicionales en diluciones donde el indicador visual o las valoraciones potenciométricas carecen de la precisión requerida.
voltamperometría
La voltametría implica cambios en la concentración de la entidad electroactiva por oxidación o reducción en la capa superficial del electrodo indicador, como oro, platino, carbón vítreo o mercurio. La corriente resultante se representa en función del potencial aplicado.
Lectura relacionada: Técnicas de análisis
Técnicas de análisisEn polarografía, un electrodo de mercurio que gotea reemplaza a los electrodos de superficie plana. Se aplica un programa de potencial que varía continuamente entre el electrodo de gota de mercurio y el electrodo de referencia y los cambios de corriente resultantes se representan frente al voltaje aplicado. El potencial de media onda se usa para la estimación cualitativa del analito y la altura de la ola se puede usar para estimaciones cuantitativas.
La voltametría se adapta a diversas aplicaciones analíticas con analitos inorgánicos y orgánicos en muestras ambientales, farmacéuticas, alimentarias, clínicas y metalúrgicas.
Electrogravimetría y coulometría
En ambas técnicas, la electrólisis se realiza hasta que el analito disponible se oxida por completo o se reduce al producto final. En electrogravimetría, el producto se pesa en el punto final como un depósito en uno de los electrodos. Por otro lado, la coulometría mide la cantidad de corriente.
Lectura relacionada: Ventajas de los espectrofotómetros UV-Visible de haz doble sobre los de haz único
Ventajas de los espectrofotómetros UV-Visible de haz doble sobre los de haz únicoconductimetría
La conductimetría consiste en medir la conductividad de la solución durante las determinaciones volumétricas.
Las determinaciones conductimétricas son útiles para investigar las constantes de disociación de ácidos y bases débiles, productos iónicos del agua y productos de solubilidad de sales poco solubles.
La química analítica descansa sobre una base sólida de técnicas analíticas. Los artículos subsiguientes cubrirán otras agrupaciones.
Deja tus comentarios y sugerencias sobre el artículo.